
题目列表(包括答案和解析)
16. (1)已知:4Fe3+ + 2H2O
(1)已知:4Fe3+ + 2H2O
 Fe2+ +
4H+ + O2↑每生成32gO2,电子转移的物质的量为
Fe2+ +
4H+ + O2↑每生成32gO2,电子转移的物质的量为
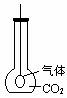
(2)如右图所示,用烧瓶收集CO2气体,在瓶内有一只扎紧在玻璃管末端的气球,打开塞子,迅速往瓶内加入Na2O2立即塞紧塞子,一段时间后,可观察到的现象为 。
(3)氯气是有毒的,曾被法西斯制成毒气用于侵略战争。当这种毒气弹顺风爆炸时,通常可用的防御方法是 A:人、畜躲在 的地方(填“低洼”或“较高”)。
B:可用 浸湿软布蒙面。(从①肥皂水 ②尿 ③石灰水 ④纯碱水 ⑤NaOH溶液,填序号)。
(4)有F-、Cl-、I-、Br2、I2五种粒子,其中氧化性最强的是 ;还原性最强的是 ,用离子方程式来表示这两种粒子间所发生的反应 。
15.下列说法错误的是 ( )
A.用稀盐酸清洗做焰色反应的镍铬丝 B.用酒精萃取碘水中的碘
C.用25mL的碱式滴定管量取14.80mL的NaOH溶液
D.氯水或硝酸银溶液存放在配有磨口塞的棕色玻璃瓶中
|
序号 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
分数 |
|
|
|
|
|
|
|
|
|
序号 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
|
|
分数 |
|
|
|
|
|
|
|
|
第II卷(非选择题 共60分)
14.对于反应H- +NH3 == H2 + NH2-,下列说法中正确的是 ( )
A.该反应属于置换反应 B.该反应中H-是氧化剂
C.该反应中NH3是还原剂 D.氧化产物和还原产生都是氢气
13.按F、Cl、Br、I的顺序,下列对卤素性质叙述错误的是 ( )
A.原子半径依次增大 B.卤化氢稳定性依次减弱
C.单质的氧化性依次增强 D.单质的熔沸点依次升高
12.将一定量的Na2CO3·10H2O与NaHCO3的混合物完全溶解于水,配成100mL溶液,测得溶液中Na+的浓度为0.4mol/L,若将溶液蒸干并灼烧到质量不变,可得到固体的质量是 ( )
A. 0.92g B. 1.68g C. 2.12g D. 2.55g
11.反应8NH3 + 3Cl2 == 6NH4Cl + N2中,当有2mol NH3被氧化时,转移的电子总数是 ( )
A.6个 B.6NA C. 1.5NA D .8NA
10.用NA表示阿伏加德罗常数,下列说法正确的是 ( )
A.1L0.2mol/L Ba(OH)2溶液中含有0.2NA个NO3-
B.标准状况下,22.4L氯气中所含的氯原子数为NA
C.16g O2中所含的氧原子数为NA
D.常温常压下1mol氦气所含有的核外电子数为4NA
9.某学生配制1mol/L的NaOH溶液100mL,结果实际浓度偏高,造成的原因是 ( )
A.天平称量结束时,指针指向标尺左边 B.洗涤液全部转移互容量瓶中
C.摇匀后,凹液面低于刻度线 D.定容时俯视刻度线
8.某溶液中含有大量的Ag+、Cu2+、Ba2+三种离子中的两种和NO3-、Cl-、OH-、CO32-、四种阴离子中的两种。该溶液中大量含有的四种离子应该是 ( )
A.Ag+、Cu2+、NO3-、Cl- B。Ag+、Ba2+ 、Cl-、OH-、
C.Cu2+、Ba2+ NO3-、Cl- D。Ag+、Cu2+、 NO3-、CO32-
7.下列反应的离子方程式正确的是 ( )
A.碳酸钙溶于醋酸:CaCO3 + 2 H+ = Ca2+ + 2 H2O + CO2↑
B.澄清石灰水中加入盐酸:Ca(OH)2 + 2H+ = Ca2+ + 2H2O
C.氯气通入水中:Cl2 + H2O = 2H+ + Cl- + ClO-
D.小苏打溶液和硫酸混合:HCO3- + H+ = H2O + CO2↑
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com