
题目列表(包括答案和解析)
1、 在科学史上中国有许多重大的发明和发现,为世界现代物质文明奠定了基础。以下发明或发现属于化学史上中国对世界重大贡献的是( )
(1)造纸 (2)印刷技术 (3)火药 (4)指南针
(5)炼铜、炼铁、炼钢 (6)合成有机高分子材料
(7)人工合成牛胰岛素 (8)提出原子--分子论学说
A、(1)(2)(3)(4)(8) B、 (1)(3)(5)(7)
C、(2)(4)(6) D、(5)(6)(7)(8)
31.解:反应后隔板处于正中央,左右压强相等,则两边气体物质的量相等。(1分)依题意,设起始时左侧中N2为1 mol,则右侧中H2、O2共3 mol,反应后右侧剩余气体1mol,反应中消耗H2、O2共2mol(1分)
根据反应式 2H2 + O2 2H2O
(1分)
2H2O
(1分)
反应消耗的H2为
 ×2 mol
=
×2 mol
= 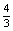 mol
mol
O2为 ×2mol
=
×2mol
=  mol
(1分)
mol
(1分)
(1)若剩余气体为H2,则起始时H2的物质的量为:
n(H2)=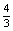 mol +
1mol=
mol +
1mol= mol
mol
则原混合气中V(H2):V(O2)=7:2 (1分)
(2)若剩余气体为O2,则起始时O2的物质的量为:
n(O2)= mol
+1mol =
mol
+1mol =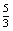 mol
mol
则原混合气中V(H2):V(O2)=4:5 (1分)
答:反应前H2和O2的体积比为7:2或4:5
30.解: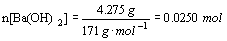 (1分)
(1分)
溶液已呈碱性,Ba(OH)2过量
Ba(OH)2 + H2SO4 = BaSO4 + 2H2O
1 mol 1 mol
x 2.33/233 mol
解得x=0.0100 mol
剩余OH-的物质的量:0.100 mol·L-1×0.100 L = 0.0100 mol
n(HCl)=0.0250 mol 52-0.0100 mol - 0.0100 mol 52 = 0.0200 mol (1分)
因此, (1分)
(1分)
 (1分)
(1分)
29.(1)在天平左盘上放一小烧怀,右盘上放砝码。(1分)
(2)将NaOH固体溶解后放置至室温。(1分)
(3)将NaOH溶液转移至500 mL容量瓶中。 (1分)
(4)用蒸馏水洗涤烧杯、玻璃棒2-3次,并将洗涤液转移至容量瓶中。(2分)
(5)当液面距刻度2-3cm处时,改用胶头滴管加蒸镏水,至溶液凹面与刻度相切。 (2分)
(6)倒转摇匀,将溶液倒入指定试剂瓶中。(1分)
28. Na2S、 Na2SO3、Na2CO3 (2分,Na2S与Na2SO3中少1个或2个扣1分,Na2CO3 1分。)
(1)Na2SO3 + 2Na2S + 3H2SO4 = 3Na2SO4 + 3S↓+ 3H2O
(或Na2SO3 + H2SO4 = H2SO3 + Na2SO4
Na2S + H2SO4 = H2S + Na2SO4
H2SO3 + 2H2S = 3S↓+ 3H2O) (3分,分步写分步给分)
(2)CuSO4 + H2S = CuS↓+ H2SO4 (1分)
(3)Ca(OH)2 + CO2 = CaCO3↓+H2O (1分)
27.(1)A、C (各1分,共2分)
(2)B、D (各1分,共2分) B 浓H2SO4有强氧化性,H2S(气)还原性强,二者会发生氧化还原反应;
D H2密度比空气小,不能用向上排气法收集。(3分,错1个扣1分,全错不给分。)
26.(1) O S Se Te Po (2分,错1个扣1分,错2个即为0分)
 (1分)
(1分)
(2)> (1分)
(3)< (1分)
(4)> (1分)
(5)溶液由无色变为蓝色 (1分) 2KI + Cl2 = 2KCl + I2 (2分)
(6)红色褪去,变为无色溶液 (1分) 红色恢复 (1分) 溶液由红色变为无色(1分)
31.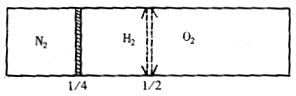 (7分)如图所示,密闭容器中有一个可以左右滑动的密封的隔板。在常温下,左侧装入N2,右侧装入H2和O2的混合气体,隔板正处于容器长度的1/4处静止不动,用电火花引燃H2和O2的混合气体,充分反应后,恢复至起始温度,隔板处于容器的正中间,静止不动。
(7分)如图所示,密闭容器中有一个可以左右滑动的密封的隔板。在常温下,左侧装入N2,右侧装入H2和O2的混合气体,隔板正处于容器长度的1/4处静止不动,用电火花引燃H2和O2的混合气体,充分反应后,恢复至起始温度,隔板处于容器的正中间,静止不动。
试计算反应前H2和O2的体积比。 高一化学期末模拟试题答案(第二卷)
30.(4分)硫酸和盐酸组成的混合液100.0 mL,向里面加入氢氧化钡粉末4.275g,充分反应后,经过滤、洗涤、干燥,得到沉淀2.330g,同时测得滤液中的OH-离子浓度为0.100 mol·L-1 。请分别求出原混合液中氯离子,硫酸根离子的物质的量的浓度。(设溶液总体积始终不变)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com