
题目列表(包括答案和解析)
11].(40分)用双线桥分析下列氧化还原反应(写出得失电子数,化合价升降,被氧化被还原),并完成下列填空。
(1)C + 4HNO3(浓)  CO2↑ + 4NO2↑ + 2H2O
CO2↑ + 4NO2↑ + 2H2O
氧化剂 ,还原剂 ,
12克碳参与反应可得到 克还原产物。
(2)3S + 6NaOH  2Na2S + Na2SO3 + 3H2O
2Na2S + Na2SO3 + 3H2O
被氧化的元素是 ,被还原的元素是 ,氧化产物 ,还原产物 ,氧化剂与还原剂的质量比是 ,该反应的离子方程式为:
(3)5NaCl + NaClO3 + 3H2SO4 = 3Cl2↑ + 3Na2SO4 + 3H2O
被氧化的物质是 ,被还原的物质是 ,氧化产物与还原产物的质量比是 ,该反应的离子方程式为:
(4)2KMnO4 + 16HCl = 2MnCl2 + 5Cl2↑ + 2KCl + 8H2O
被氧化的元素是 ,被还原的元素是 ,反应中被氧化的盐酸和未被氧化盐酸的质量比是 ,该反应的离子方程式为:
10].(6分)写出下列离子方程式相应的化学方程式
(1)Al+3Ag+=Al3++3Ag
(2)CO32-+CO2+H2O=2HCO3-
9].(6分)写出下列离子方程式
(1)CO2使澄清石灰水变浑浊
(2)氨水(NH3·H2O)和醋酸(CH3COOH或HAc)混合
4. (4分)现有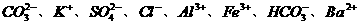 八种离子,请按要求填写:
八种离子,请按要求填写:
(1)只能与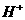 大量共存的有_________。
大量共存的有_________。
(2)只能与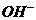 大量共存的有_________。
大量共存的有_________。
(3)既能与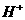 大量共存,又能与
大量共存,又能与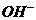 大量共存的有_________。
大量共存的有_________。
(4)既不能与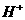 大量共存,又不能与
大量共存,又不能与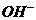 大量共存的有_________。
大量共存的有_________。
22、用双线桥表示下列氧化还原反应,标出反应前后化合价升降情况和被氧化、被还原情况及电子转移的方向和数目

⑴ MnO2+4HCl(浓)==MnCl2+2H2O+Cl2↑
还原剂 还原产物
(2) 2K+2H2O==2KOH+H2↑
氧化剂 ,氧化产物
18、下列反应的离子方程式中,正确的是
A.大理石和盐酸:CO32-+2H+==H2O+CO2↑
B.铁和稀盐酸:2Fe+6H+==2Fe3++3H2↑
C.稀硫酸和氨水:H++NH3·H2O==NH4++H2O
D.碳酸氢钾溶液和盐酸:HCO3-+H+==H2O+CO2↑
15. 只用一种试剂就能将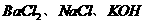 三种溶液区别开,此试剂是( )
三种溶液区别开,此试剂是( )
A. 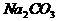 B.
盐酸 C.
硫酸 D.
B.
盐酸 C.
硫酸 D.
 溶液
溶液
已知反应X+Y=M+N 为放热反应,对该反应的下列说法中正确的是( )
A. X的能量一定高于M
B. Y的能量一定高于N
C. X和Y的总能量一定高于M和N的总能量
D. 因该反应为放热反应,故一定不必加热就可发生
14. 下列物质中属于电解质的是( )
①NaOH ②BaSO4 ③Cu ④蔗糖 ⑤SO2
A. ①② B. ①②⑤ C. ③④ D. ①⑤
13. 能用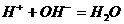 的离子方程式表示下列化学反应的是( )
的离子方程式表示下列化学反应的是( )
A.  溶液和盐酸反应 B.
溶液和盐酸反应 B.
 和硫酸反应
和硫酸反应
C. 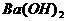 和醋酸反应 D.
和醋酸反应 D.
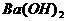 和硫酸反应
和硫酸反应
12. 在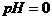 的无色透明溶液中,能大量共存的离子组是( )
的无色透明溶液中,能大量共存的离子组是( )
A. 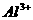 、
、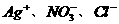 B.
B.
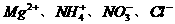
C. 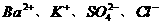 D.
D.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com