
题目列表(包括答案和解析)
1.元素周期表的编排原则
按原子序数递增的顺序从左到右排列;将电子层数相同的元素排成一个横行;把电子层数相同的元素(个别例外)按电子层数递增的顺序从上到下排成纵行。
3.元素周期律的实质:元素性质周期性的变化是元素原子核外电子排布的周期性变化的必然结果。
[例1] 下列事实一般不能用于判断金属性强弱的是 ( B )
A.金属间发生的置换反应
B. 1mol金属单质在反应中失去电子的多少
C.金属元素的最高价氧化物对应的水化物的碱性强弱
D.金属元素的单质与水或酸置换出氢的难易
[例2] A、B、C、D、E是同周期的五种主族元素,A和B的最高价氧化物的水化物均呈碱性,且碱性B>A,C和D的气态氢化物的水溶液均显酸性,且酸性C>D,五种元素形成的简单离子中,E离子的半径最小,则它们的原子序数由大到小的顺序为 ( A )
A. C、D、E、A、B B.E、C、D、A、B 、
C.A、B、D、C、E D.B、A、E、D、C
[例3] 铍的性质类似于铝,下列有关铍性质的推断正确的是 ( B )
A. 铍能与冷水反应
B. 氢氧化铍能与强酸、强碱溶液反应
C.氧化铍的化学式为Be203
D.氧化铍只溶于强酸溶液,不溶于强碱溶液
2.元素周期律的内容:元素性质随着原子序数的递增而呈周期性的变化。即随着原子序数的递增:原子核外电子排布、原子半径、元素主要化合价、元素的金属性与非金属性呈现周期性的变化。
1、填表(以11号-18号元素为例元素性质的变化规律)
|
元素 |
11Na |
12Mg |
13A1 |
14Si |
15P |
16S |
17C1 |
18Ar |
||
|
(1)电子排布 |
电子层数相同,最外层电子数从1依次递增到8 |
|||||||||
|
(1)原子半径, |
 原子半径(递减) 原子半径(递减) |
不可 |
||||||||
|
|
比 |
|||||||||
|
(3)主要化合价 |
十1 |
十2 |
+3 |
十4 -4 |
十5 -3 |
+6 -2 |
+7 -1 |
|
||
|
(4)金属性、非金属性 |
 金属性(减弱),非金属性(增强) 金属性(减弱),非金属性(增强) |
|||||||||
|
(5)单质与水或酸反 应置换氢难易 |
与水剧烈反应 |
与水加热缓慢反应 |
与酸反应,但速率比镁慢 |
______ |
__ |
|||||
|
(6)氢化物化学式 |
______ |
SiH4 |
PH3 |
H2S |
HCl |
__ |
||||
|
(7)与H2化合的难易 程度 |
______ |
 由( 难 )到( 易 ) 由( 难 )到( 易 ) |
|
__ |
||||||
 |
||||||||||
|
(8)氢化物稳定性 |
______ |
 稳定性(增大) 稳定性(增大) |
__ |
|||||||
|
(9)最高价氧化物化 学式 |
Na20 |
MgO |
Al2O3 |
SiO2 |
P205 |
S03 |
C1207 |
__ |
||
|
最高价 |
(10)化学式 |
NaOH |
Mg(OH)2 |
Mg(OH)2 |
H4Si04 |
H4Si04 |
H2S04 |
HCl04 |
__ |
|
|
氧化物 |
(11)酸碱性 |
强碱 |
中强碱 |
两性氢氧化物 |
弱酸 |
中强酸 |
强酸 |
最强酸(同周期) |
__ |
|
|
对应水 化物 |
(12)变化 规律 |
 碱性(减弱),酸性(增强) 碱性(减弱),酸性(增强) |
__ |
|||||||
3. 两性氧化物是指既能与酸反应生成盐和水,又能与碱反应生成盐和水的氧化物。既能与酸反应生成盐和水,又能与碱反应生成盐和水的氢氧化物是与碱反应生成盐和水。
2.元素的金属性是指元素的原子失电子的能力,原子越容易失电子,元素的金属性越强;反之,元素的金属性越弱。元素的金属性的强弱,一般可以从它的单质跟水(或酸)反应置换出氢的难易程度,以及“它的最高价氧化物的水化物一一氢氧化物的碱性强弱”来判断。
素的非金属性是指元素的原子得电子的能力,原子越容易得电子,元素的非金属性越强;反之,元素的非金属性越弱。元素的非金属性的强弱,一般可以从它的最高价氧化物的水化物的酸性强弱或氢气生成气态氢化物的难易程度以及气态氢化物的稳定性来判断。
1.原于序数:
按核电荷数由小到大的顺序给元素编的号,原子序数=核电荷数=核内质子数。
[知识回顾]
2.医学上常给病人口服Na126I溶液来诊断甲状腺疾病。这是由于合成甲状腺激素的重要原料是 ( C )
A.铁 B.钙 C.碘 D.钠
[例3] 设某元素某原子核内的质子数为m,中子数为n,则下述论断正确的是 ( A )
A.不能由此确定该元素的相对原子质量
B.这种元素的相对原于质量为m+n
C.若碳原于质量为Wg,此原子的质量为(m+n)Wg;
D.核内中子的总质量小于质子的总质量
[例4] 有关核外电子运动规律的描述错误的是 ( C )
A.核外电子质量很小,在原子核外作高速运动
B.核外电子的运动规律与普通物体不同,不能用牛顿运动定律来解释
C.在电子云示意图中,通常用小黑点来表示电子绕核作高速圆周运动
D.在电子云示意图中,小黑点密表示电子在核外空间单位体积内电子出现的机会多
[例5] 电子总数相等的微粒种类很多。电子总数为10的微粒;
(1)单核离子有Na+ Mg2+ Al3+ N3- O2- F-等。
(2)多核离子有H3O+ NH4+ CH5 + OH- NH2- CH3-等。
(3)分子有Ne HF H20 NH3 CH4等。
[例6] 有A、B、C、D四种元素,其中A元素是1826年一位法国青年科学家发现的。他在研究海水制盐时,往剩余的副产物苦卤中通人氯气后,发现溶液颜色变深,再经过进一步提取可得一种红棕色有刺鼻臭味的液体,这就是A元素的单质。B、C、D均属短周期元素;D的原子核内质子数是C原子核内质子数的2倍,且它们原子的最外层上电子数相等。B原子核外的电子数是D 原子的最内层上电子数的一半。则这四种元素分别为A Br、B H、C O、D S 。由上述某元素的单质与另两种元素的化合物反应生成两种酸的化学方程式为Br2 + H2O === HBr + HBrO。
[例7] 已知五种元素的原子序数的大小顺序为C>A>B>D>E;A、C同周期,B、C同主族;A与B形成的离子化合物A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核10个电子分子。试回答下列问题:
(1)写出五种元素名称:A钠B氧C硫 D硫 E氢。
(2)画出C元素的离子结构示意图 S2-
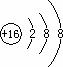 。
。
(3)写出下列物质的电子式:D元素形成的单质 ,E与B形成的化合物H∶....∶H或H∶....∶....∶H,A、B、E形成的化合物Na+[∶....∶H ]-,D与E形成的化合物
,E与B形成的化合物H∶....∶H或H∶....∶....∶H,A、B、E形成的化合物Na+[∶....∶H ]-,D与E形成的化合物
H∶....∶H。
(4)用电子式表示离子化合物A2B的形成过程:2Na× + ·....· --→ Na+[....]2- Na+ 。
第二节 元素周期律
1.某种蔬菜施含放射性同位素15N的氮肥,植物吸收后主要用于合成蛋白质。人食用该种蔬菜后,通过代谢15N最终出现在B中。
A.氨基酸 B.尿素 C.氨 D.蛋白质
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com