
题目列表(包括答案和解析)
1.离子晶体:一般地化学式及结构相似时,阴阳离子的半径越小、电荷数越高,熔、沸点越高。如:KF > KCl > KBr > KI。
|
晶体类型 |
离子晶体 |
原子晶体 |
分子晶体 |
金属晶体 |
|
|
1.构成微粒 |
阴、阳离子 |
原子 |
分子 |
金属离子、自由电子 |
|
|
2.微粒间作用力 |
离子键 |
共价键 |
分子间作用力(即范德华力) |
金属键(即金属离子与自由电子间的静电作用) |
|
|
3.熔沸点 |
较高 |
很高 |
一般较低 |
有的高、有的低 |
|
|
4.硬度 |
硬而脆 |
很硬 |
较小 |
一般较硬少数软 |
|
|
5.溶解性 |
一般易溶于极性溶剂,难溶于非极性溶剂 |
难溶于一般溶剂 |
极性相似相溶 |
难溶于一般溶剂(Na等与水反应) |
|
|
6. 导 |
①晶体 |
不导电 |
不导电 |
不导电 |
导电 |
|
电 |
②熔融 |
导电 |
不导电 |
一般不导电 |
导电 |
|
性 |
③溶液 |
溶于水能导电 |
- |
水溶液能导电 |
- |
|
7.其它 |
难挥发,密度大 |
不挥发 |
大部分有挥发性 |
延展性、导热性好 |
|
|
8.实例 |
CaO、NaCl、KOH等 |
金刚石、Si02等 |
He、Cl2、C60、H20、H2S04、NH3·H2O、CH3CH20H等 |
Na、Mg、Al等 |
注:根据表中有关项目的比较,可以反推晶体类型。
非极性物质易溶于_________溶剂而难溶于_________溶剂;极性物质易溶于溶剂而难溶于_________ 溶剂。如苯____溶于植物油而______溶于水;HCl____溶于水而______溶于苯。
[例 1] 下列物质的电子式书写正确的是 ( C )
A.氨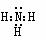 B.氯化镁 Mg2+[:C1:] -2
B.氯化镁 Mg2+[:C1:] -2
C.氮气  D.二氧化碳
D.二氧化碳 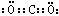
[例 2] 实验测得Be2Cl2为共价化合物,两个Be-Cl键间的夹角为180°。由此可见,Be2Cl2属于 ( B )。
A.由极性键构成的极性分子 B.由极性键构虚的非极性分子
C.由非极性键构成的极性分子 D.由非极性键构成的非极性分子
[例 3] 将几种分子晶体在水和四氯化碳中的溶解情况填入下表:
|
|
蔗糖 |
磷酸 |
碘 |
萘 |
|
(1)水 |
易溶 |
易溶 |
不易溶 |
不易溶 |
|
(2)四氯化碳 |
不易溶 |
不易溶 |
易溶 |
易溶 |
2. 极性分子与非极性分子
(1)分子的极性由键的极性与分子的对称性_两方面共同决定。填表:
|
分子中原子数 |
类型 |
分子形状 |
分子的极性 |
代表物 |
|||||
|
2 |
①A2 |
直线型 |
非极性 |
H2、N2 |
|||||
|
②AB |
极性 |
HCI、CO |
|||||||
|
3 |
③如A=B=A |
直线型 |
非极性 |
C02、CS2 |
|||||
|
B /\ ④ A A |
折线型 |
极性 |
|
||||||
|
4 |
⑤AB3 |
平面正三角型 |
非极性 |
BF3、BCl3 |
|||||
|
|
⑥AB3 |
三角锥型 |
极性 |
NH3 |
|||||
|
⑦A4 |
正四面体型 |
非极性 |
P4 |
||||||
|
5 |
⑧AB4 |
正四面体型 |
非极性 |
CH4、SiCl4 |
|
||||
|
|
⑨AB3C |
四面体型 |
极性 |
CH4、SiCl4 |
|
||||
|
|
⑩AB2C3 |
四面体型 |
极性 |
CH2Cl2 |
|
||||
(2)判断ABn型分子极性的经验规律;若中心原子A的化合价的绝对值等于该元素所在的主族序数,则为_________分子;若不等,则为_________分子
1. 由同种原子间形成的共价键是非极性键_;由不同种原子间形成的共价键是极性键。
3.可以用电子式、结构式表示共价键。
(1)用电子式表示共价键,应根据原子最外层电子数,及各种原子形成相对稳定的结构时所需形成的共用电子对数书写电子式。
(2)用“电子式表示共价键的形成过程”,必须用“→”连接,“→”左边写原子的电子式,右边写物质的电子式。
(3)用一根短线表示一对共用电子对_的式子叫结构式。
2.根据形成共价键的数目可分为单键、双键_、三键 ;根据键的极性可分为极性键_、非极性键。
1. 共价键是原于间通过共用电子对所形成的相互作用。
[知识结构]
2.离子的性质
离子和相应的原子由于结构不同,因此,性质也不同;金属原子只有还原性,而最高价金属离子只有氧化性,且金属的还原性越强,其对应阳离子的氧化性越弱;非金属原子一般具有氧化性,而最低价非金属离子只有还原性,且非金属原子氧化性越强其对应阴离子还原
性越弱。
[例 1] 下列化合物中阴离子半径和阳离子半径之比最大的是 ( A )
A.LiI B.NaBr C.KCI D,CsF
[例 2] 下列有关阳离子的说法中错误的是 ( D )
①阳离子都是由一个金属原子失去电子而形成的 ②非金属原子不能形成阳离子 ③阳离子的电子排布一定与稀有气体相同 ④阳离子的价态不会大于其原子的最外层电子数 ⑤阳离子都是稳定结构,不会再失去电子
A.①④ B.②④ C.①②③ D.①②③④⑤
[例 3] 下列说法正确的是 ( C D )
A.阴、阳离子间的相互吸引作用叫离子键
B.化学键只存在于分子之内,原子之间 :
C.一个阴离子可以同时与多个阳离子间有静电作用
D.分子内或晶体中,不相邻的原子问也存在相互作用但作用力较弱,不属于化学键
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com