
题目列表(包括答案和解析)
25.(5分)把1摩尔钠和1摩尔铝的混合物小心地投入954克水中,充分反应后溶液的质量分数为多少?
24.(5分)已知:I-、Fe2+、Br-离子还原能力的强弱顺序为:I->Fe2+>Br-。现有含FeI2、FeBr2各0. 1 mol的混合溶液200 mL,向其中缓慢地通入氯气(假定Cl2分子只与溶质离子反应,不考虑其它反应):
(1)若有0. 1 mol Cl2被还原,则所得溶液中含有的主要阴离子为: ;
(2)若原溶液中Br- 有一半被氧化,共消耗Cl2的质量为 g;将反应后的溶液加水稀释至400mL,其中主要的阳离子是 ,其物质的量浓度为 。
(3)试判断Cl2、I2、Fe3+、Br2四种氧化剂的氧化能力由强到弱的顺序为: 。
23.(18分)(1)地壳中某主要元素是现代许多高科技产品的重要组成元素之一,足见化学对现代物质文明起作重要的推动作用。请根据你的所见所闻填写以下空白:
①光导纤维的主要成分 (填写化学式)
②目前应用最多的太阳能电池的光电转化材料是 (填写名称)
③神奇无比的集成电路芯片的主要成分 (填写名称)
④用作吸附剂、催化剂的载体的人造分子筛大多是一类为 (填写名称)
⑤写出工业上以某矿物为原料制备该元素的高纯度单质的化学方程式
(2)下列五个图中,横坐标表示加入的物质的量,纵坐标表示生成沉淀的量从A-E中选择各题要求的序号填入表中
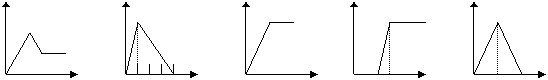
A B C D E
|
溶液 |
加入的物质 |
答案序号 |
|
MgCl2
和AlCl3的混和液 |
滴加NaOH至过量 |
|
|
NaAlO2溶液 |
滴加稀HCl至过量 |
|
|
含少量NaOH的NaAlO2溶液 |
通过量的CO2 |
|
|
AlCl3溶液 |
通过量的NH3 |
|
|
饱和石灰水 |
通CO2至过量 |
|
(3)类比思维是化学研究中常用的思维方法,它能帮助研究人员从一个问题出发来巧妙地解决一类本质相似的问题。已知:过氧化钠几乎可与所有的常见气态非金属氧化物反应。
如:Na2O2+CO=Na2CO3 2Na2O2+2CO2=2Na2CO3+O2 。
试回答下列问题:
①写出Na2O2分别与SO2、SO3反应的化学方程式:
。
。
②请你总结归纳出过氧化钠与常见气态非金属氧化物发生反应的规律:
22.(10分)某学生拟用下图装置组装成一套装置验证过量的锌与浓硫酸反应的产物,试回答下列问题:
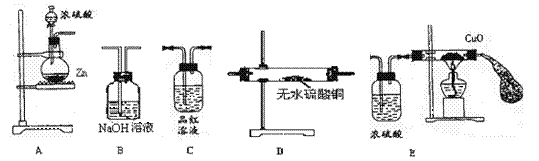 (1)这些装置连接的正确顺序是(填A.B.C.D.E):
(1)这些装置连接的正确顺序是(填A.B.C.D.E):
A --→D--→ --→ --→
(2)实验中观察到C中的现象为 ,结论是 ;D中的现象为 ,结论是 ;
(3)B中反应的化学反应方程式为 ;
(4)反应一段时间后可观察到E中玻璃管中的黑色固体变为紫红色,由此可证明产物中有 ,试解释反应初始阶段未观察到此现象的原因:
。
21.(共13分)
(1)在生产、生活和科学实验中经常需要进行混合物的分离。以下实验中应选择下列哪种分离方法?(填写序号)①纸上层析 ②过滤 ③萃取 ④蒸发结晶 ⑤蒸馏
a.海水淡化
b.用海水晒盐
c.从溴水中提取溴
d.分离豆浆和豆渣
e.实验室分离墨水中的染料可用
(2)范老师在课堂上演示了如下实验:她在试管中加入2 mL 0.2 mol·L-1的CuSO4溶液,再加入3 mL 0.2 mol·L-1的NaOH溶液,恰好反应。结果得到的沉淀并不是蓝色的,而是浅绿色的;她请同学们思考这是为什么? 小英同学通过查找资料得知,该浅绿色沉淀物可能是溶解度极小的碱式硫酸铜,其化学式为Cu4(OH)6SO4。
①请帮小英同学写出生成浅绿色沉淀的化学反应方程式
________________________________________________。
②请帮小英同学设计一个简单实验,证明Cu4(OH)6SO4中含有硫酸根离子。
_____________________________________________________________________
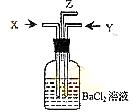 (3)已知二氧化硫能被稀硝酸氧化。现将碳跟浓硫酸共热产生
(3)已知二氧化硫能被稀硝酸氧化。现将碳跟浓硫酸共热产生
的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足
量氯化钡溶液的洗气瓶中(如图装置),洗气瓶中沉淀的化
学式为 ;在
Z导管口观察到的现象是
20.向一定量的 FeO、Fe、Fe3O4 Fe2O3的混合物中加入200ml1mol·L-1的盐酸,恰好使混合物完全溶解,放出224ml(标准状况)的气体,在所得溶液中加入KSCN溶液无血红色出现.若用足量的CO在高温下还原相同的质量的此混合物,能得到铁的质量是( )
A.11.2g B.5.6g C.2.8g D.无法计算
19.阿伏加德罗常数的值约为6.02×1023 mol-1,下列叙述中错误的是: ( )
A.标准状况下,2.24L的N2与O2的混合气体中所含分子总数为0.1×6.02×1023
B.1mol CH3+(碳正离子)中含有的电子数为8×6.02×1023
C.1L0.2mol/L的KClO3溶液中所含氯离子的数目为0.1 ×6.02×1023
D.在2H2S+SO2==3S+2H2O反应中,当有32g还原产物生成时,转移电子为2 ×6.02×1023
18.用加热的方法可分离下列物质的是 ( )
A.碘和食盐 B.氯化铵和氯化钡
C.氯化铵和消石灰 D.碳铵和过氧化钠
17.工业废气中氮氧化物是主要的大气污染源之一。已知2NO2+2NaOH=NaNO3+NaNO2+H2O,
NO2+NO+2NaOH=2NaNO2+H2O。现有a mol NO2和b mol NO的混合气,若用足量的
NaOH溶液将其完全吸收,则混合气中两种气体的物质的量必须满足的关系是 ( )
A.a=b/3 B.2a=b C.a≥b D.a<b
16.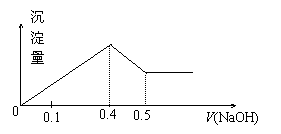 现有AlCl3和MgSO4混合溶液,向其中不断加入NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如图所示,原溶液中Cl-与SO42-的物质的量之比为 ( )
现有AlCl3和MgSO4混合溶液,向其中不断加入NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如图所示,原溶液中Cl-与SO42-的物质的量之比为 ( )
A.1:3 B.2:3
C.6:1 D.3:1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com