
题目列表(包括答案和解析)
4. 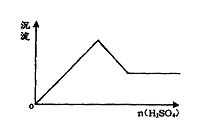 向一无色透明的溶液中滴加稀硫酸时有沉淀生成且所得沉淀量与所加硫酸的关系如图所示,则原溶液可能是
向一无色透明的溶液中滴加稀硫酸时有沉淀生成且所得沉淀量与所加硫酸的关系如图所示,则原溶液可能是
A.Na2SiO3与Na2CO3的混合溶液
B.NaAlO2与Na2S2O3的混合溶液
C.AlCl3与CuSO4的混合溶液
D.AlCl3与Na2S的混合溶液
3. 下列物质的性质比较,正确的是
A.热稳定性:Na2CO3>NaHCO3>H2CO3
B.熔点:K>Na>Li
C.溶解度:NaHCO3>Na2CO3
D.氧化性:K+>Na+>Li+
2. 下列实验中用错试剂的是
A.用热碱液清洗做过油脂实验的试管 B.用碱石灰吸收氨气中的水蒸气
C.用酒精萃取碘水中的碘 D.用酒清浸泡试管中残留的少量酚醛树脂
1. 下列实验室中分离或除杂质的方法中不正确的是
A.用升华法分离碘和碘化钠固体混合物 B.用加热法除去氯化钙中混有的氧化铵
C.用蒸馏法分离乙醇和丁醇混合物 D.用萃取法除去溴苯中混有的溴单质
22.(6分)常温下,在27.5g水中溶解12.5gCuSO4.5H2O,恰好达到饱和,该溶液密度为1.21g/cm3。求
(1)该溶液中阴阳离子的总物质的量
(2)该溶液中CuSO4的物质的量浓度
21.(6分)在标准状况下,将224L HCl气体溶于635mL水中,所得盐酸的密度为1.18g/cm3。试计算:
(1)所得盐酸的质量分数和物质的量浓度。
(2)取出这种盐酸100mL,稀释至1.18L,所得稀盐酸的物质的量浓度。
20.(8分)2003年3月日本筑波材料科学国家实验室一个研究小组发现首例带结晶水的
晶体在5K下呈现超导性。据报道,该晶体的化学式为 Na0.35CoO2 • 1.3H2O。试计算:该晶体的摩尔质量是 ;钴原子与氧原子的物质的量之比是 ;钴原子与氧原子的个数之比是 ;1mol该晶体中含有的氧原子数目是 。(比值可以用小数表示)
19.(10分)mg某气体,它由双原子分子构成,它的摩尔质量为Mg·mol-1。若阿伏加
德罗常数用NA表示,则:
(1)该气体的物质的量为________mol。
(2)该气体所含原子总数为_______ _个。
(3)该气体在标准状况下的体积为____________L。
(4)该气体溶于1L水中(不考虑反应),其溶液中溶质的质量分数为______ _。
(5)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为_____ g·mol-1。
18.(10分)实验室配制0.1mol/L的BaCl2溶液分成两个阶段:第一阶段:用托盘天平称取5.2g无水BaCl2晶体。第二阶段:溶解配制成0.1mol/L的BaCl2溶液。第一阶段操作有如下几步:
A.将游码拨至0.2g处;
B.将游码拨至“0”处;
C.在天平的两边托盘上各放一张干净等质量的滤纸,调节天平两边螺丝使天平平衡;D.取走药品,将砝码放回砝码盒内;
E.往左盘内逐步添加晶体至天平平衡;
F.在右盘放置5g砝码。
(1)其正确的操作顺序是(填序号):___________________
(2)当E操作时,只缺少量晶体时,其操作是_____________________________
(3)第二阶段操作,应先将5.2gBaCl2加适量蒸馏水溶解,溶解过程中使用的主要仪器有_______________________,然后将溶液转入_________中,再_________、___________、___________后即可得到0.1mol/LBaCl2溶液。
(4)下列操作使配制的BaCl2溶液浓度偏低的有__________
A.如果将砝码放在左盘上,BaCl2放在右盘上进行称量
B.如果选用的容量瓶内有少量蒸馏水
C.如果定容摇匀后,液面下降,又加水到刻度线
D.如果整个配制过程中,容量瓶不振荡
17.(11分)粗食盐中除含有钙离子、镁离子、硫酸根离子等可溶性杂质外,还含有泥砂
等不溶性杂质。我们食用的精盐是用粗食盐提纯而得到的。通过教材中“粗盐的提纯”及你做过的该实验回答下列问题。
(1)实验室进行NaCl溶液蒸发时,一般有以下操作过程 ①放置酒精灯 ;②固定铁
圈位置 ;③放上蒸发皿(蒸发皿中盛有NaCl溶液);④加热搅拌; ⑤停止加热。其正确的操作顺序为 。
(2)如何运用最简方法检验溶液中有无SO42-离子? 。如
果有,应该如何除去SO42-离子? 。
(3)在粗盐经过溶解→过滤后的溶液中滴加饱和Na2CO3溶液,直至不再产生沉淀为
止。请问这步操作的目的是 。
(4)将经过操作(3)后的溶液过滤。请问这一操作能除掉哪些杂质?
。
(5)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要
用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的;
溶解时: 、过滤时: 、蒸发时: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com