
题目列表(包括答案和解析)
镁的提取
|
|






|



 海水 母液
MgCl2
海水 母液
MgCl2
|
 a
溶液
a
溶液
|


 贝壳 石灰乳
贝壳 石灰乳
CaCO3 === CaO + CO2↑
CaO + H2O ===Ca(OH)2(石灰乳)
Ca(OH)2 + MgCl2 ===Mg (OH)2↓+ CaCl2
|
MgCl2 === Mg + Cl2↑
物理性质
镁是银白色金属,有金属光泽,密度较小,硬度较大,质地柔软,熔点较低,是热和电的良导体。
化学性质
|
|
|
2Mg + CO2 === 2MgO + C
2、与水的反应
Mg+2H2O === Mg(OH)2+H2↑
Na2CO3的性质(水溶液呈碱性)
(1)与碱反应 Na2CO3 + Ca(OH)2 === CaCO3↓ + 2NaOH
(2)与盐反应 Na2CO3 + BaCl2 === BaCO3↓ + 2NaCl
(3)与CO2反应: Na2CO3 + CO2 + H2O ===2NaHCO3
Na2CO3与NaHCO3的性质比较
2、与水的反应
2Na + 2H2O === 2NaOH + H2↑ ( 浮、溶、游、红 )
钠的性质
物理性质
银白色固体、有金属光泽、密度比煤油大比水小、质软、熔点低、能导电导热。
化学性质
1、与O2、Cl2、S等非金属的反应
|
|
|
2Na + S === Na2S (火星四射,甚至发生爆炸)
4.溶解性:Cl2溶于水,Br2和I2难溶于水;Br2和I2易溶于汽油、酒精、苯、CCl4等有机溶剂。
I2的检验:试剂:淀粉溶液 现象:溶液变蓝色
Br- 、I- 的检验:
试剂:AgNO3溶液和稀硝酸
现象:产生浅黄色沉淀(含Br-);黄色沉淀(含I-)
例:NaBr + AgNO3 = AgBr↓ + NaNO3
NaI + AgNO3 = AgI↓+ NaNO3
第二单元 钠、镁及其化合物
3.熔、沸点:液态溴易挥发,碘受热易升华
2.颜色:黄绿色(Cl2)→深红棕色(Br2)→紫黑色(I2),颜色由浅到深
溴和碘的化学性质 元素非金属性(氧化性)强弱顺序:Cl > Br > I
|
实验 |
实验现象 |
化学方程式 |
|
氯水与溴化钾溶液的反应 |
溶液由无色变为橙黄色 |
2KBr+Cl2=2KCl+Br2 |
|
氯水与碘化钾溶液的反应 |
溶液由无色变为黄褐(黄)色 |
2KI +Cl2=2KCl+I2 |
|
溴水与碘化钾溶液的反应 |
溶液由无色变为黄褐(黄)色 |
2KI+Br2=2KBr+I2 |
单质的物理性质
1.状态:气态(Cl2)→液态(Br2)→ 固态(I2)
4.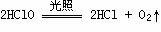 不稳定性:
不稳定性:
氯气的用途: 来水的消毒、农药的生产、药物的合成等
1.酸性 2.氧化性 3.漂白性
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com