
题目列表(包括答案和解析)
3.Na2SiO3的性质:Na2SiO3易溶于水,水溶液俗称“水玻璃”,是建筑行业的黏合剂,也用于木材的防腐和防火。
化学性质主要表现如下:
(1)水溶液呈碱性(用PH试纸测),通CO2有白色沉淀:Na2SiO3 + CO2 + H2O == Na2CO3 + H2SiO3↓(白色胶状沉淀),离子方程式:SiO32- + CO2 + H2O == CO32- + H2SiO3↓。
硅酸受热分解:H2SiO3
 H2O + SiO2 ,
H2O + SiO2 ,
原硅酸和硅酸都是难溶于水的弱酸,酸性:H2CO3强于H4SiO4或H2SiO3。
(2)硅酸钠溶液中滴加稀盐酸有白色沉淀:
Na2SiO3 + 2HCl == 2NaCl + H2SiO3↓,离子方程式:SiO32- + 2H+ == H2SiO3↓.
(3)硅酸和氢氧化钠反应:H2SiO3 + 2NaOH == Na2SiO3 + 2H2O.
离子方程式:H2SiO3 + 2OH- ==SiO32- +2H2O 。
2.硅酸盐的结构:
(1)硅酸盐的结构复杂,常用氧化物的形式表示比较方便。硅酸盐结构稳定,在自然界中稳定存在。
(2)氧化物形式书写的规律:
①各元素写成相应的氧化物,元素的价态保持不变。
②顺序按先金属后非金属,金属元素中按金属活动顺序表依次排列,中间用“•”间隔。
③注意改写后应与原来化学式中的原子个数比不变。
1.硅在自然界的存在:地壳中含量仅次于氧,居第二位。(约占地壳质量的四分之一);无游离态,化合态主要存在形式是硅酸盐和二氧化硅,
第三单元 含硅矿物与信息材料
铁的化学性质:铁是较活泼的金属(或中等活泼金属)表现为还原性。
|
|
铁 |
|
||||||||||
|
(1)与非金属反应 |
①铁生锈(铁在潮湿空气中被腐蚀生成Fe2O3)
④3Fe+2O2 === Fe3O4(2价Fe占 |
Cu +O2 === 2CuO
|
||||||||||
|
(2)与酸反应 |
①非强氧性的酸:Fe + 2H+
== Fe2+ + H2↑ ②强氧性的酸(浓H2SO4、HNO3): a.常温下钝化(浓H2SO4、浓HNO3用铁制容器盛装) b.一定条件下反应生成Fe(Ⅲ) |
①非强氧性的酸: 不反应 ②强氧性的酸(浓H2SO4、HNO3):在一定条件下生成Cu(Ⅱ) |
||||||||||
|
(3)与盐溶液反应 |
(1) Fe + Cu2+ == Fe2+ + Cu (2) Fe + 2Fe3+ == 3Fe2+ |
Cu + 2Ag+=2Ag + Cu2+ Cu + 2Fe3+=2Fe2+ + Cu2+(实验现象:铜粉溶解,溶液颜色发生变化。) |
Fe2+与Fe3+的相互转化:
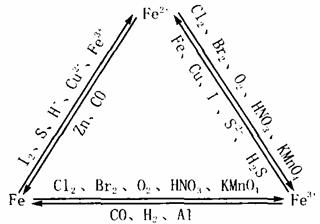
Fe3+的检验:(黄棕色)
实验①:向FeCl3 溶液中加入几滴KSCN溶液,溶液显血红色,
Fe3++3SCN- Fe(SCN)3
Fe(SCN)3
实验②:向FeCl3溶液加入NaOH溶液,有红褐色沉淀。
Fe3++2OH- Fe(OH)3↓
Fe(OH)3↓
Fe2+的检验:(浅绿色)
实验:向FeCl2溶液加入NaOH溶液。
Fe2++2OH- Fe(OH)2↓(白色/浅绿色)4Fe(OH)2+O2+2H2O
Fe(OH)2↓(白色/浅绿色)4Fe(OH)2+O2+2H2O 4Fe(OH)3(红褐色)
4Fe(OH)3(红褐色)
|
|
|
(3) 除SiO2:CaCO3===CaO+CO2↑,CaO+SiO2===CaSiO3
炼铜:1.高温冶炼黄铜矿→电解精制;2.湿法炼铜:Fe + CuSO4 = FeSO4 + Cu;3.生物炼铜
(1) 与酸的反应:Al(OH)3 + 3HCl = AlCl3 + 3H2O
(2) 与碱的反应:Al(OH)3 + NaOH = NaAlO2 + 2H2O
Al(OH)3的制备:
H2O
铝盐( AlCl3 ) Al(OH)3↓ 偏铝酸盐( NaAlO2 )
往AlCl3溶液中滴入NaOH溶液:先有白色沉淀产生,后消失;
往NaOH溶液中滴入AlCl3溶液:先无明显现象,后有沉淀产生。
第二单元 铁、铜及其化合物的应用
(1) 与酸的反应:2Al + 6HCl = 2AlCl3 + 3H2↑
(2) 与碱的反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑
第一步:2Al+6H2O= 2Al(OH)3+3H2↑
第二步:Al(OH)3+NaOH=NaAlO2+2H2O
★ 总方程式: 2Al+2NaOH+6H2O=2NaAlO2+ 4H2O +3H2↑
(3) 钝化:在常温下,铝与浓硝酸、浓硫酸时会在表面生成致密的氧化膜而发生钝化,不与浓硝酸、浓硫酸进一步发生反应。
(4)
|
2Al + Fe2O3 === 2Fe + Al2O3
铝热剂:铝粉和某些金属氧化物(Fe2O3、FeO、Fe3O4、V2O5、Cr2O3、MnO2)组成的混合物。
①溶解:Al2O3+2NaOH === 2NaAlO2+H2O
②过滤:除去杂质
③酸化:NaAlO2+CO2+2H2O === Al(OH)3↓+NaHCO3
|
⑤灼烧:2Al(OH)3 ======= 4Al+3O2↑
铝合金特点:1、密度小2、强度高3、塑性好4、制造工艺简单5、成本低6、抗腐蚀力强
3、与酸的反应
Mg + H2SO4 === MgSO4 + H2↑
用途
1)镁合金的密度较小,但硬度和强度都较大,因此被用于制造火箭.导弹和飞机的部件
2)镁燃烧发出耀眼的白光,因此常用来制造通信导弹和焰火;
3)氧化镁的熔点很高,是优质的耐高温材料
专题3 从矿物到基础材料
第一单元 从铝土矿到铝合金
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com