
题目列表(包括答案和解析)
2.下列微粒中,不具有还原性的微粒是( )
A.H2 B.H+ C.HCl D.S2-
1.氧化还原反应的实质是( )
A.反应中有电子得失或电子对的偏移 B.反应中有氧原子的得失
C.元素化合价发生变化 D.反应后生成新的物质
27.(7分)8.70g MnO2与100mL 37.0%密度为1.19g/cm3的浓盐酸共热(假设HCI没有损失),反应结束后,将剩余的溶液加水稀释至1000mL。取出10mL溶液加入足量AgNO3溶液,有白色沉淀生成。求
(1)反应中生成的Cl2在标准状况下的体积. (2)10.0mL溶液加入AgNO3溶液后生成沉淀的物质的量.
26.(10分)在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气。进行此实验,所用仪器如下图:
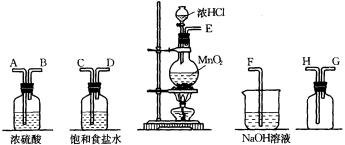 (1)连接上述仪器的正确顺序是(填各接口处的字母):E接 ,_____接 ,_____接H,G接F。
(2)在装置中:①饱和食盐水起的作用是
,
②浓硫酸起的作用是
。
(3)化学实验中检验是否有Cl2产生常用湿润的淀粉-KI试纸。如果有Cl2产生,可观察到的现象是
,写出反应方程式
。
(4)写出下列化学反应的离子方程式:
①气体发生装置中进行的反应: ;
(1)连接上述仪器的正确顺序是(填各接口处的字母):E接 ,_____接 ,_____接H,G接F。
(2)在装置中:①饱和食盐水起的作用是
,
②浓硫酸起的作用是
。
(3)化学实验中检验是否有Cl2产生常用湿润的淀粉-KI试纸。如果有Cl2产生,可观察到的现象是
,写出反应方程式
。
(4)写出下列化学反应的离子方程式:
①气体发生装置中进行的反应: ;
②尾气吸收装置中进行的反应: 。
25.(6分)实验室配制500 mL 0.5 mol·L-1的NaCl溶液,有如下操作步骤:①把称量好的NaCl晶体放入小烧杯中,加适量蒸馏水溶解;②把①所得溶液小心转入500mL容量瓶中;③继续向容量瓶中加蒸馏水至液面距离刻度2-3厘米处,改用胶头滴管小心滴加蒸馏水至溶液凹液面底部,与刻度线相切;④用少量蒸馏水洗涤烧杯和玻璃棒2-3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀;⑤将容量瓶塞紧,充分摇匀。 请填写下列空白: A.实验操作步骤的正确顺序为(填序号) 。 B.本实验用到的基本仪器有: 。 C.若出现如下情况,对所配溶液浓度将有何影响?没有进行操作④ (偏高,偏低或不变);加蒸馏水时不慎超过了刻度 (偏高,偏低或不变)。 D.若实验过程中出现如下情况如何处理?加蒸馏水时不慎超过了刻度 ;向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面 。
24.(12分)下列物质中都含有杂质(括号内为杂质),试选用合适的试剂和分离方法除去杂质。 填写下表:
|
含杂质的物质 |
除杂试剂 |
分离方法 |
反应的化学方程式 |
|
(1)Cl2(HCl) |
|
|
|
|
(2)NaCl固体(NaI) |
|
|
|
|
(3)NaNO3溶液(NaCl) |
|
|
|
23.(14分)A.B.C三种固体物质的焰色反应为黄色,分别跟水发生化学反应均得物质D的溶液;A跟水反应还有O2生成,B跟水反应还有H2生成,C跟水反应是化合反应:
(1)A为______________ B为______________ C为______________ D为______________
(2)由B生成A的化学方程式__________________________________________。
(3)由A变为D的化学方程式__________________________________________。
(4)由B变为D的化学方程式__________________________________________。
22.(7分)标出下列反应的电子转移方向和数目,并填写有关内容:
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O ① 元素得电子, 元素被氧化。 ②氧化剂与还原剂的物质的量比是 。 ③若有7.3 gHCl被氧化,产生Cl2的质量为_______。 ④离子方程式为: 。
21.(4分)在标准状况下,4g H2,11.2L O2,1mol H2O中,所含分子数最多的是______,含原子数最多的是________,质量最大的是________,体积最小的是________。
20.某温度下,将C12通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定ClO-与ClO3-的浓度之比为1:3,则Cl2与NaOH溶液反应时被还原的氯元素与被氧化的氯元素的物质的量之比为 A.21:5 B. 11:3 C.3:1 D.4:1
第Ⅱ卷(非选择题,共60分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com