
题目列表(包括答案和解析)
15.已知H2(g)+ 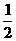 O2(g)=H2O(g);△H=-242kJ/mol
O2(g)=H2O(g);△H=-242kJ/mol
H2(g)+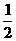 O2(g)=H2O(l);△H=-286kJ/mol
O2(g)=H2O(l);△H=-286kJ/mol
将标准状况下的H2和O2混合气体点燃后,再恢复到原状况时,气体体积减少3.36L,反应放热为 ( )
A.24.2kJ B.28.6kJ C.57.2kJ D.72.6kJ
14.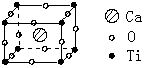 许多物质在通常条件下是以晶体的形式存在,而一种晶体又可 视作若干相同的基本结构单元构成,这些基本结构单元在结构化学中被称作晶胞。已知某化合物是由钙、钛、氧三种元素组成的晶体,其晶胞结构如图所示,则该物质的化学式为
( )
许多物质在通常条件下是以晶体的形式存在,而一种晶体又可 视作若干相同的基本结构单元构成,这些基本结构单元在结构化学中被称作晶胞。已知某化合物是由钙、钛、氧三种元素组成的晶体,其晶胞结构如图所示,则该物质的化学式为
( )
A.Ca4TiO3 B.Ca4TiO6
C.CaTiO3 D.Ca8TiO12
13.在373K时,在一密闭容器中充入一定物质的量的NO2和SO2,发生如下反应:
 NO2+SO2 NO+SO3,当反应达平衡时,下列叙述正确的时
NO2+SO2 NO+SO3,当反应达平衡时,下列叙述正确的时
A.NO和SO3的物质的量一定相等
B.NO2和SO2的物质的量一定相等
C.平衡体系中总物质的量一定等于反应开始时总物质的量
D.SO2、NO2、NO、SO3的物质的量一定相等
12.已知a元素的阳离子,b元素、c元素的阴离子具有相同的电子层结构,且a元素的阳离子半径小于b的阴离子半径,b的阴离子半径大于c的阴离子半径,则其原子序数大小顺序为 ( )
A.c>b>a B.a>b>c C.a>c>b D.c>a>b
11.锂亚硫电池具有能量密度高和保存期限长等优点,可以大倍率放电,是重要的军用电池。它的电极材料分别是金属锂和石墨,由四氯化铝锂(LiAlCl4)溶解在亚硫酰氯(SOCl2)中形成电解质。电池总反应式为:10Li+4SOCl2=8LiCl+Li2SO4+3S,下列有关说法正确的是 ( )
A.金属锂是电池的正极
B.电子由锂电极经导线流向石墨电极
C.电池供电时负极发生氧化反应
D.正极的电极反应是:4SOCl2-10e-=SO42-+8Cl-+3S
10.下列叙述中不正确的是 ( )
A.镀锌的铁皮,破损后铁皮反而易被腐蚀
B.纯铁比生铁更易被腐蚀
C.金属的电化腐蚀比化学腐蚀普遍
D.金属腐蚀的本质是因M-ne‑?=Mn+而被损耗
9.反应2A(g)  2B(g)+E(g);△H
=+a kJ/mol(a>0)达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是
( )
2B(g)+E(g);△H
=+a kJ/mol(a>0)达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是
( )
A.加压 B.减压
C.减少E的浓度 D.降温
8.最近科学界合成一种“二重结构”的球形物质分子,是把足球型C60分子容纳在足球型Si60分子中,外面的硅原子与里面的碳原子以共价键结合。下列关于这种物质的叙述中正确的是 ( )
A.是混合物 B.是化合物 C.不含极性键 D.其晶体是原子晶体
7.把下列四种X溶液,分别加进四个盛有10mL浓度为2 mol·L-1 的盐酸的烧杯中,然后都加水稀释至50mL。X和盐酸都能缓慢地进行反应,其中反应速率最大的是 ( )
A.10 mL、2 mol·L-1 B.20 mL、2 mol·L-1
C.10 mL、4 mol·L-1 D.20 mL、3 mol·L-1
5.A、B、C是三种金属,根据下列①、②两个实验,确定它们的还原性强弱顺序为( )
①当A与B用导线相连后浸在稀硫酸中时,A上有气泡逸出,B逐渐溶解。
②电解物质的量浓度相同的A、C盐溶液时,阴极上先析出C(使用惰性电极)。
A.A>B>C B.B>C>A C.C>A>B D.B>A>C
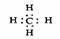
 6.下列表达方式错误的是 ( )
6.下列表达方式错误的是 ( )
A.甲烷的电子式: B.氟化钠的电子式:
C.硫离子的电子式:S2- D.碳-12原子: 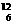 C
C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com