
题目列表(包括答案和解析)
2. 当原子的最外层电子数发生改变时,会引起改变的是( )
A. 相对原子质量 B. 元素种类 C. 中子数 D. 化学性质
1. 能保持物质化学性质的粒子是( )
A. 分子 B. 质子 C. 中子 D. 电子
3. 应用:根据粒子示意图判断阴阳离子和原子,化合价,化学式
① 原子:质子数=核外电子数;阴离子:质子数<核外电子数;阳离子:质子数>核外电子数
② 化合价是元素的性质;单质的化合价为零;离子化合物和共价化合物化合价原理不同
离子化合物中化合价与得失电子有关,得电子为负,失电子为正,数目与得失电子数目相同;
共价化合物中化合价与共用电子对有关,偏向为负,偏离为正,数目与共用电子对数目有关;
化合价规则:化合物中,元素正负化合价的代数和为零。
③ 在写化学式的同时,特别要注意化合价与元素符号的下表是否匹配
典型习题:
2. 了解:分子、原子、离子、元素的概念、区别、联系;原子的构成;相对原子(分子)质量
① 分子、原子、离子都是构成物质的粒子。
分子构成的物质:共价化合物(如:水、酒精、二氧化碳等);大部分非金属单质(如:氢气、氧气、氮气、硫等)
原子构成的物质:金刚石、石墨、单晶硅;稀有气体;金属单质
离子构成的物质:离子化合物(如氯化钠、氢氧化钙等)
注:(1)单一的离子是不能够形成物质的。例如:氯化钠是由氯离子与钠离子形成的,千万不能说是由氯化钠离子形成的
(2)离子化合物是通过阴阳离子相互吸引而形成的,共价化合物是通过共用电子对形成的
(3)判断方法:由金属元素(或铵根)与非金属元素形成的化合物都是离子化合物,完全由非金属元素形成的化合物是共价化合物
简单的判别方法:看其化合物的名称中是否有“钅”字旁,如有则是离子化合物,没有则是共价化合物
② 原子是由质子、中子、电子构成的,但并不是所有的原子中都含有三种粒子(如:氢原子中没有中子)
③ 相对原子质量=质子数+中子数(仅是数值关系)
相对分子质量=Σ(各原子相对原子质量)
④ 分子、原子、离子为微观概念;物质、元素为宏观概念
在做选择题、填空题中应注意概念的微观宏观匹配性
1. 常识:核外电子排布,原子结构示意图,原子团的概念
① 核外电子的分层排布,能量低的靠近原子核;第一层(K层)最多排2个电子,第二层(L层)最多排8个电子,最外层最多排8个电子;先排满内层,在排外层;
原子团在化学变化中,有可能改变
② 硝酸根离子NO3-;氯酸根离子ClO3-;氢氧根离子OH-;碳酸氢根离子HCO3-;碳酸根离子CO32-;硫酸根离子SO42-;锰酸根离子MnO42-;高锰酸根离子MnO4-;磷酸根离子PO43-;铵根离子NH4+
③ 注意原子结构示意图与离子结构示意图之间的区别:判断元素种类,根据核内质子数;判断是离子还是原子,根据核外电子总数与核内质子数
④ 地壳中含量前四位:氧(O)硅(Si)铝(Al)铁(Fe);空气中含量最多的元素:氮(N);海洋中含量最多的元素:氧(O)
⑤ 原子的最外层的电子数决定了:元素的化学性质,元素的分类,元素的化合价
(二)
1.消毒酒精中酒精的体积分数为70%-75%,则消毒酒精中的溶剂是( )
A.水 B.酒精 C.酒 D.说不定
2.一杯20℃的KNO3饱和溶液,下列方法能改变其溶质质量分数的方法是( )
A.恒温蒸发掉10g水,有晶体析出 B.在该温度下,加入少许KNO3晶体
C. 升温 D. 温度降到10℃,有KNO3,晶体析出
3.对10%的食盐溶液含义的解释错误的是( )
A. 100克水中溶解了10克食盐 B. 100克食盐溶液中含有10克食盐
C. 将10克食盐溶于90克水中所得溶液 D. 食盐与溶液的质量比是1:10
4.常用抗生素“先锋Ⅵ”为粉末状固体,每瓶含“先锋Ⅵ”0.5g,注射时应配成质量分数不高于20%的溶液,则使用时每瓶至少需加入蒸馏水( )
A.1mL B. 2 mL C. 3mL D. 4 mL
5.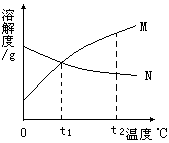 右图是M、N两种物质的溶解度曲, 由溶解度曲线得出以下几条信息,你认为正确的是( )
右图是M、N两种物质的溶解度曲, 由溶解度曲线得出以下几条信息,你认为正确的是( )
A.t1℃时,M、N两物质溶液溶质质量分数相等
B.由t1℃升温到t2℃时,N物质溶液溶质质量分数不变
C.M物质的溶解度大于N物质的溶解度
D.N物质的溶解度随温度的升高而降低
6.已知食盐和纯碱晶体的溶解度如下表所示
|
|
0℃ |
10℃ |
20℃ |
30℃ |
|
NaCl/g |
35.7 |
35.8 |
36.0 |
36.3 |
|
Na2CO3·10H2O/g |
7 |
12.5 |
21.5 |
38.8 |
从表中数据分析:分离氯化钠和纯碱晶体混合物的最佳温度是 。
若将含少量氯化钠的纯碱晶体制成高温下的饱和溶液,当调节到最佳分离温度时,结晶出来的晶体主要是 。为了提高晶体的纯度,应将过滤出的晶体用 (填“冷”或“热”)水进一步洗涤干净。
7.现有80 g质量分数为10%的硝酸钠溶液,试回答下列问题:
(1)上述硝酸钠溶液中含溶质的质量为 ,
(2)若向上述溶液中加入20 g水,则所得溶液中溶质的质量分数为 ;
(3) 若使上述溶液溶质质量分数变为20%,则应加入硝酸钠 g;或蒸发水 g;
(4) 若使上述溶液中溶质的质量分数变为5%,则应加水 g
(一)
1.如图所示已平衡的天平两端放着两个分别盛有浓盐酸和浓硫酸的敞口烧杯,过一段时间后,天平会( )
A、左端下沉 B、右端下沉 C、仍平衡 D、无法判断
2、下列溶液中,跟铁片充分反应后,所得的溶液质量比反应前质量减轻的是( )
A、稀盐酸 B 稀硫酸 C 硫酸亚铁溶液 D 硫酸铜溶液
3、下列物质溶于水所得溶液能使紫色石蕊试液变蓝色是( )
A、SO2 B、CO C、Na2O D、SO3
4、热水瓶中有较多水垢时,某学生欲用家中现有物质除去水垢,你认为下列方法可行的是( )
A、用热碱水浸泡后洗净 B、用洗涤剂浸泡后洗净
C、用食醋浸泡后洗净 D、用食盐水浸泡后洗净
5、现有失去标签的相同体积的两瓶液体,一瓶是98%的浓硫酸,另一瓶是10%的稀硫酸,请你用学过的物理和化学知识,各用两种方法将它们鉴别出来。
物理方法:①
②
化学方法:①
②
6、某一无色溶液具有如下性质:①与硫酸铜溶液反应可产生蓝色沉淀②使无色酚酞试液变红③与碳酸钠溶液反应产生白色沉淀,据以上推断,此溶液是( )
A.氢氧化钠溶液 B.澄清石灰水 C.氯化钙溶液 D.盐酸
7、侯德榜是我国著名的化学家,由他发明的侯氏制碱法得到纯碱中可能含有少量杂质氯化钠,现取仅含氯化钠杂质的纯碱样品33.2克,加入130克稀盐酸中,恰好完全反应,得氯化钠溶液150克。求(1)该纯碱样品中碳酸钠的质量(2)反应后所得溶液中溶质的质量分数
1、下列物质敞口放置在空气中,因发生化学变化而质量增加的是( )
A.浓硫酸 B.饱和氯化钠溶液 C.氢氧化钙固体 D.浓盐酸
2、某种消化药片的有效成分是氢氧化镁,能减缓胃酸过多引起的疼痛。在氢氧化镁与胃酸作用的过程中,胃液pH变化的情况是( )
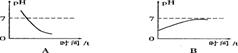

3、下列各组中的两种物质混合,能生成氯化铜的是( )
A、 Cu(OH)2和HCl B、 AgCl和Cu C 、FeCl2和Cu D 、HCl和Cu
4、使用pH试纸测试醋酸溶液的pH时,若先用蒸馏水将试纸润湿,再将待测溶液滴在试纸上,则测得的pH 与实际值的关系为( )
A、 变大 B、不变 C、 变小 D 、不能确定
5、酸具有相似的化学性质的原因是( )
A、组成中都含氢元素 B、组成中都含有酸C、水溶液中都有氢离子 D、水溶液都有酸味
6、洗涤内壁附有难溶性碱的下列仪器的正确方法是( )
A、用蒸馏水洗 B、用稀HCl洗C、先用稀HCl洗,再用水洗D、用NaOH溶液洗
7、中和一定质量、一定质量分数的稀硫酸,需要用m克NaOH,若改用KOH m克时,反应后溶液的加紫色石蕊应当( )
A、显红色 B、显紫色 C、显蓝色 D、无法确定
8、检验某溶液是不是酸时,不能选用的试剂是( )
A、无色酚酞试液 B、紫色石蕊试液 C、碳酸钠溶液 D、锌粒
9、下列物质中有一种物质能与其它三种物质发生反应:该物质是( )
A、石灰石 B、稀盐酸 C、硝酸银 D、烧碱
10、向一瓶无色透明的溶液中滴入紫色石蕊试液,溶液呈现红色,说明该溶液是( )
A、酸的水溶液 B、碱的水溶液 C、碱性溶液 D、酸性溶液
11、按下列要求写出生成氯化锌的化学方程式:
①碱与酸 ②盐与酸
12、已知某无色溶液里含有硫酸,则该溶液中还可能含有的物质是( )
A、硫酸铜 B、氯化钡 C、硫酸锌 D、氢氧化钠
C级
1、一种无色溶液能与氯化钡溶液反应,生成了不溶于稀硝酸的白色沉淀,则此无色溶液为( )
A、一定是硝酸银溶液 B、一定是稀硫酸
C、一定是可溶性的含SO42-的物质 D、无法确定
2、某同学在实验中由于违反了实验规则,皮肤上溅了一些浓硫酸,以下处理方法:①用较多的水冲洗②用氢氧化钠溶液冲洗③用布拭去皮肤上的浓硫酸④涂上3%-5%的
NaHCO3溶液,你认为正确的顺序为( )
A、③②④ B、③①④ C、②③④ D、①②③④
3、氯化钙溶液中含有少量盐酸,欲将盐酸除去,得到较纯净的氯化钙溶液,则应向溶液中加入( )A、纯碱 B、氢氧化钠溶液 C、硝酸钾溶液 D、石灰石
初三化学错题重考试卷
(一)浓盐酸、浓硫酸的特殊性
1、浓盐酸是 的水溶液,为 色,有 气味的液体,易 ,所以如果敞口放置在空气中会形成 ,同时溶液的 减小。工业盐酸因含有杂质而呈 色。
2、浓硫酸是 、 状液体,具有 性、 性,溶于水时 ,(与之类似的物质还有 、 。)所以稀释浓硫酸时应将倒入 中,同时不断 ,如果顺序反了可能 。
 (二)酸的化学性质
(二)酸的化学性质
1、酸的化学性质(有注意点的做标注,能写出方程式的写一个方程式)
① .
② .
③ .
④ .
⑤ .
2、稀盐酸、稀硫酸具有相似化学性质的原因: 。
2.溶液的酸碱度测定:
溶液的酸碱度可以用来 测定,用 表示,当pH=0时溶液呈 性。测定溶液pH需要用到的仪器主要有 ,如果测定前用水润湿试纸,溶液的pH变化是 。
 使紫色石蕊溶液变红的溶液一定是
溶液,使无色酚酞变红的溶液一定是 溶液,碳酸钾和碳酸钠从物质类别上说属于
,但它们的溶液呈 性,能使无色酚酞试液变
。
使紫色石蕊溶液变红的溶液一定是
溶液,使无色酚酞变红的溶液一定是 溶液,碳酸钾和碳酸钠从物质类别上说属于
,但它们的溶液呈 性,能使无色酚酞试液变
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com