
题目列表(包括答案和解析)
2.下列物质中,不能电离出酸根离子的是 ( )
A.Na2S B.Ba(OH)2 C.KMnO4 D.KCl
1.下列物质中,能够导电的电解质是 ( )
A.Cu丝 B.熔融的MgCl2 C.NaCl溶液 D.蔗糖
16、(1)OH-Cl-K+(2)铁粉Ag
(3)OH-、Cl-、Ag+、Fe3+KNO3
解析:(1)甲厂的废水明显呈碱性,即含大量OH-,而Ag+、Fe3+与OH-不能共存,故Ag+、Fe3+只能在乙厂废水中,由于C1-与Ag+不共存,故Cl-在甲厂中,依电荷守恒,甲厂废水中必含的阳离子只能为K+。所以甲厂废水含OH-、C1-、K+,乙厂废水中含Ag+、Fe3+、NO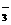 。
。
(2)加入铁粉回收银Fe+2Ag+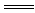 Fe2++2Ag↓
Fe2++2Ag↓
(3)混合后OH-与Fe3+、Ag+;C1-与Ag+转化为沉淀,剩下的只有KNO3。
点评:解答离子共存题,要看清题目,审准题意,挖掘出隐含条件。有的离子虽不存在于书面上的离子组中,但有时在条件中“隐含”出现,如某强酸性(或强碱性)溶液中能大量共存,说明溶液中除离子组内各离子外,还应有H+(或OH-)。此外,还要注意溶液是否有颜色。如Cu2+、Fe3+、MnO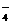 等都有颜色,若为无色则说明其不存在。
等都有颜色,若为无色则说明其不存在。
15、(1)2H++SO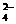 +Ba2++2OH-
+Ba2++2OH-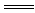 BaSO4↓+2H2O
BaSO4↓+2H2O
(2)Ba2++SO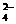
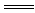 BaSO4↓
BaSO4↓
解析:因NaHSO4是二元强酸的酸式盐,可以理解成全部电离。当反应后溶液呈中性时其反应式是2NaHSO4+Ba(OH)2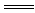 BaSO4↓+Na2SO4+2H2O,离子反应式是2H++SO
BaSO4↓+Na2SO4+2H2O,离子反应式是2H++SO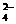 +Ba2++2OH-
+Ba2++2OH-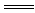 BaSO4↓+2H2O。此时中性溶液中只有Na2SO4溶液,加入B(OH)2的离子反应式为Ba2++SO
BaSO4↓+2H2O。此时中性溶液中只有Na2SO4溶液,加入B(OH)2的离子反应式为Ba2++SO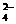
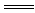 BaSO4↓。
BaSO4↓。
点评:酸式盐和碱的反应,情况比较复杂。因为由于加入碱的量不同,其产物有所不同,所以建议对此类问题先写成化学方程式再改写成离子方程式。
14、(1)K2CO3+H2SO4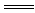 K2SO4+H2O+CO2↑
K2SO4+H2O+CO2↑
(2)AgNO3十NaCl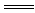 AgCl↓+NaNO3
AgCl↓+NaNO3
(3)CuSO4+2NaOH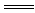 Na2SO4+Cu(OH)2↓
Na2SO4+Cu(OH)2↓
(4)SO2+2NaOH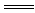 Na2SO3十H2O(或其他合理答案)
Na2SO3十H2O(或其他合理答案)
13、(1)Fe2O3+6H+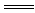 2Fe3++3H2O
2Fe3++3H2O
(2)CO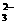 +2H+
+2H+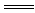 H2O十CO2↑
H2O十CO2↑
(3)Cu2++SO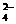 +Ba2++2OH-
+Ba2++2OH-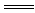 BaSO4↓+Cu(OH)2↓
BaSO4↓+Cu(OH)2↓
(4)Ca2++2OH-+CO2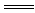 CaCO3↓+H2O
CaCO3↓+H2O
12、(1)S0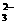 、CO
、CO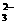
(2)SO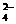 、S0
、S0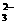 、CO
、CO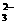
(3)Ba2+Ag
解析:当溶液中有大量H+存在时,H+与S0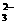 、CO
、CO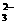 会生成气体SO2和CO2;Ba2+可以分别和SO
会生成气体SO2和CO2;Ba2+可以分别和SO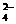 、S0
、S0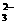 、CO
、CO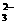 生成沉淀物;如果溶液中既含有Ba2+又含有Ag+时,上述所有阴离子都不可能存在。
生成沉淀物;如果溶液中既含有Ba2+又含有Ag+时,上述所有阴离子都不可能存在。
11、C 解析:溶液中大量共存的离子必须相互不起反应。A中Mg2+和OH-能起反应生成Mg(OH)2沉淀;B中H+和CO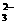 、Ca2+和CO
、Ca2+和CO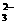 都能起反应;C中可以;D中HCO
都能起反应;C中可以;D中HCO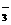 和OH-、Ca2+和OH-都能起反应。
和OH-、Ca2+和OH-都能起反应。
10、AB 解析:解本题时应采用正向思维,对每一个离子方程式进行分析。因为每一个离子方程式都应与其化学方程式及实际情况相吻合,不能随意臆造。浓硫酸与铁作用生成三价铁,而稀硫酸与铁作用则生成二价铁,故A选项不正确;Ca(HCO3)2是可溶于水的盐,应写成离子,反应前后Ca2+的数目并没有变,因此离子方程式中不应出现Ca2+,故B选项也不正确;C正确;MgCO3难溶于水,不能写成离子,D正确。
9、CD 解析:A、B不正确,因为CuCO3、BaCO3不能拆写成离子形式。C、D正确。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com