
题目列表(包括答案和解析)
4. 常温下能用铁罐或铝罐贮存的是 ( )
A.浓H2SO4 B.浓HCl C.稀H2SO4 D.稀HCl
3. 关于原子结构的叙述正确的是 ( )
A. 所有的原子核都是由质子和中子组成的
B. 原子的最外层电子数不超过8个
C. 稀有气体原子的最外层电子数均为8
D. 原子的次外层电子数一定都是8
2.下列物质的电子式书写正确的是 ( )
A 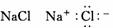 B.
B. 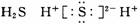

C.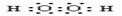 D. D.
D. D.
1.某气体在靠近地面的空气中若浓度稍大是一种污染物,而在高空形成的气层却对地球生物有保护作用,该气体是下列的 ( )
A.NO B.O3 C.CO D.CO2
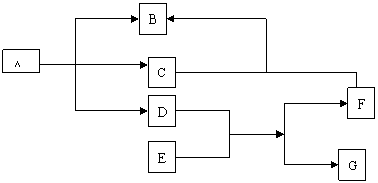 加热
加热
(1)固体E加入液体D中的现象 。
(2)A加热分解的反应方程式 。
(3)C气体通入F的溶液中的离子方程式 。
计算题(6分)
1. 25、(6分)在标准状况下,8.96L的甲烷和CO的混合气体的质量为7.6克。试回答下列问题:
[1] 混合气体的平均相对分子质量为多少 ?
[2] 混合气体中甲烷的体积多少?
[3] 混合气体中CO的质量多少 ?
附加题 (5分) 27、0.5molA元素的原子被氧化为简单离子需要失去1mol电子。0.4gA的单质与足量盐酸反应生成上述A的阳离子时,可放出0.02g氢气。通过计算确定A是什么元素
28(5分) 把2.48g MgCl2和MgSO4的混合物溶于约45 mL水中,滴加0.2 mol/L BaCl2溶液40 mL恰好沉淀完全。求原混合物中MgCl2和MgSO4的物质的量之比。
23、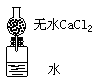 (6分)为了测定某种碱金属的相对原子质量而设计的装置如图。该装置(包括水)的总质量为ag,将质量为bg(不足量)的碱金属放入水中,立即塞紧瓶塞。完全反应后再称量此装置的质量为cg。则:
(6分)为了测定某种碱金属的相对原子质量而设计的装置如图。该装置(包括水)的总质量为ag,将质量为bg(不足量)的碱金属放入水中,立即塞紧瓶塞。完全反应后再称量此装置的质量为cg。则:
⑴列出计算该碱金属原子量的数学表达式: ;
⑵无水氯化钙的作用 ;
⑶如果不用氯化钙,求出的原子量比实际原子量偏大还是偏小 。
4、下列物质中,物质的量最大的是___________,含分子个数最多的是______,含原子个最多的是__________,质量最大的是__________。(均填字母)
A、6克H2 B、0.5摩尔CO2 C、92克C2H5OH D、148克H2SO4
E、 1.2×1024个HCl分子 F、4℃时10ml水
3.212克Na2CO3溶于水可电离出________mol Na+,_____molCO32-,将这些CO32-完全沉淀,需要____molCaCl2,最多可制取____mol气体。
2.、物质的量为1mol的12C中含有_________个12C,它们的质量是_________kg,含有同数目的氧气分子的物质的量是________mol,质量是___________kg。
1、1.6克某物质含有3.01×1022个分子,则该物质的相对分子质量为____________,摩尔质量为______。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com