
题目列表(包括答案和解析)
10.D 解析:要求溶液的物质的量浓度,需知溶质的物质的量和溶液的体积。溶液的体积不等于HCl(g)的体积,也不等于HCl(g)和H2O的体积之和,而要根据溶液的密度求得:
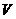 (HCl(aq))=
(HCl(aq))=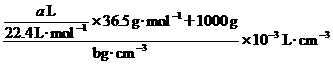
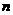 (HCl)=
(HCl)=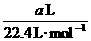
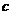 (HCl)=
(HCl)=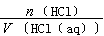 =
=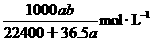
9.AD 解析:首先要理解题意,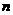 molN2和mol14CO是物质的量相等的两种气体,根据阿伏加德罗定律,可以判断A正确。
molN2和mol14CO是物质的量相等的两种气体,根据阿伏加德罗定律,可以判断A正确。
N2和14CO的摩尔质量不相等(N2∶28g·mol-1,而14CO:30g·mol-1),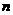 molN2和nmol14CO的质量不相等,同温同压下,它们体积相等,所以它们的密度一定不相等,在标准状况下,也属于同温(0℃)、同压(1.01×105Pa),所以它们只是体积相等,而质量不等,两种气体的物质的量相等,它们的分子数一定相等。
molN2和nmol14CO的质量不相等,同温同压下,它们体积相等,所以它们的密度一定不相等,在标准状况下,也属于同温(0℃)、同压(1.01×105Pa),所以它们只是体积相等,而质量不等,两种气体的物质的量相等,它们的分子数一定相等。
8.AD 解析:同温同压下,气体密度比等于相对分子质量之比: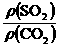 =
=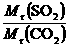 =
=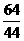 =
=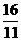 ,同温同压下,等质量的气体体积比等于相对分子质量的反比,即
,同温同压下,等质量的气体体积比等于相对分子质量的反比,即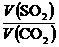 =
=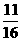 。
。
7.A 解析:依题意,原NaOH溶液的浓度是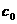 =
=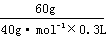 =5mol·L-1。
=5mol·L-1。
设原溶液与水混合时体积不变,则以体积比1∶4稀释即成试题所要求的溶液。因此,选项A是本题答案。
6.C 解析:物质中所含原子的物质的量最多,则物质中含原子数量最多,0.4molO2中含0.8mol原子;标准状况下5.6LCO2中所含原子为: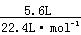 ×3=0.75mol;4℃时5.4mLH2O中含原子为:
×3=0.75mol;4℃时5.4mLH2O中含原子为: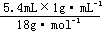 ×3=0.9mol;10gNe中所含原子为:
×3=0.9mol;10gNe中所含原子为: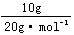 =0.5mol。
=0.5mol。
5.D解析:设气体A的相对分子质量为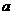 ,即A的摩尔质量为
,即A的摩尔质量为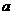 g·mol-1。根据阿伏加德罗定律,同温同压下,气体的体积比应等于其物质的量之比。则有;
g·mol-1。根据阿伏加德罗定律,同温同压下,气体的体积比应等于其物质的量之比。则有;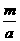 ∶
∶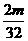 =l∶4,故
=l∶4,故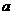 =64,选D。
=64,选D。
4.C 解析:不管在瓶中充入何种气体,在相同状况下,其体积和物质的量均是相等的。设A的相对分子质量是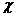 ,则根据
,则根据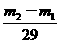 =
=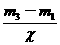 ,得
,得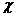 =
=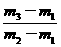 ×29。故应选C。
×29。故应选C。
3.D 解析:设阿伏加德罗常数为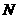 ,则依题意,可得:
,则依题意,可得: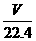 ×4
×4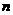 =
=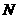 故
故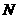 =
=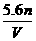 ,选D。
,选D。
2.B 解析:由已知,1滴水的体积为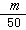 mL,又因为H2O的密度为lg·mol-3,故1滴水的质量即为
mL,又因为H2O的密度为lg·mol-3,故1滴水的质量即为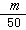 g,相当于
g,相当于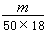 mol,所含的分子数为:
mol,所含的分子数为: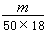 ×6.02×1023,答案选B。
×6.02×1023,答案选B。
1.C 解析:摩尔质量指的是1摩尔物质的质量,即6.02×1023个粒子的质量,因此一个该原子的真实质量可用g表示。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com