
题目列表(包括答案和解析)
5.下列事实与氢键有关的是 ( )
A.水加热到很高的温度都难以分解
B.水结冰成体积膨胀,密度减少
C.CH4、SiH4、GeH4、SnH4熔点随相对分子质量增加而升高
D.HF、HCI、HBr、HI的热稳定性依次减弱
4.以下各分子中,所有原子都满足最外层为8电子结构的是 ( )
A. H3O+ B. BF3 C. CCl4 D. PCl5
3.最近,中国科大的科学家们将C60分子组装在一单层分子膜表面,在-268℃时冻结分子的热振荡,并利用扫描隧道显微镜首次“拍摄”到能清楚分辨碳原子间单、双键的分子图像。下列化合物分子中一定既含σ键又含π键的是
A.N2 B.CO2 C.CH4 D.H2O2
2.一个价电子构型为2s22p5的元素,下列有关它的描述正确的有: A 原子序数为7 B 电负性最大
C 原子半径最大 D 第一电离能最大
1.下列图象中所发生的现象与电子的跃迁无关的是 ( )
 A
B
C
D
A
B
C
D
24.(6分)150℃、101.3kPa时,1.5L某烃CXHY蒸气能在aL氧气中完全燃烧,体积增大至(a+3)L (同温同压下测定)。
(1)该烃在组成上必须满足的条件是
(2)当a = 10L时,该烃可能的分子式为
(3)当该烃的分子式为C7H8时,a的取值范围为 。
22.(11分)某研究小组为制备消毒液(主要成分是NaClO)设计了下列装置 ,并查阅下列资料:在温度较高情况下卤素单质和碱溶液能发生如下反应:

 3X2+6OH- 5X-+XO3-+3H2O
3X2+6OH- 5X-+XO3-+3H2O
回答下列问题:
(1)仪器 A的名称为 发生装置中反应的离子方程式为:
。
(2) 饱和NaCl溶液的作用是 ,能否省去盛有浓硫酸的洗气瓶? ,理由是 .
(3)能否省去冰水冷却? ,用化学方程式表示原因是:
,大试管内发生反应的离子方程式为 。
|
|
 2SO3 其它条件不变,只改变一个反应条件,将生成SO3的反应速率的变化填入表中空格里 。(填字母 A.增大
B.减小 C.不变)
2SO3 其它条件不变,只改变一个反应条件,将生成SO3的反应速率的变化填入表中空格里 。(填字母 A.增大
B.减小 C.不变)
|
改变条件 |
速率变化 |
||
|
降低温度 |
|
||
|
增在O2的浓度 |
|
||
|
使用V2O5做催化剂 |
|
||
|
压缩气体 |
|
(2)(5分)A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。

|
|
|
①A中反应的离子方程式为 ,B中Cu极电极反应式为 。
②C中被腐蚀的金属是 ,总反应方程式为 ,
③A.B、C中铁被腐蚀的速率,由大到小的顺序是 。
21.(10分 )
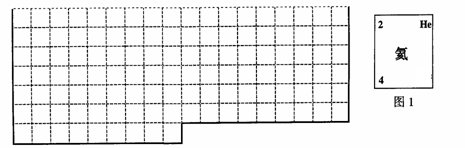
(1)上表中的实线是元素周期表部分边界,请在表中用实线补全元素周期表边界。
 (2)元素甲是第三周期ⅥA族元素,请在右边方框中按氦元素(图1)的式样,写出元素甲的原子序数、元素符号、元素名称、相对原子质量。
(2)元素甲是第三周期ⅥA族元素,请在右边方框中按氦元素(图1)的式样,写出元素甲的原子序数、元素符号、元素名称、相对原子质量。
(3)元素乙的M层上有3个电子,则乙原子半径与甲原子半径比较:________>________(用元素符号表示),甲、乙的最高价氧化物水化物相互反应的离子方程式为:
(4)元素周期表体现了元素周期律,即元素的性质随着 _________的递增呈现 _ ____的变化。
20.(6分)A、B、C均为短周期元素,在周期表中的位置如图所示:
|
|
|
||
|
A |
|
C |
|
|
|
B |
|
|
回答下列问题:
(1)A、B、C的元素符号为: 、 、 ;
(2)C的单质和水反应的化学方程式为: ;
B的最高价氧化物的水化物的化学式为: ;A的氢化物的水溶液
呈 (酸性或碱性)。
19.(4分)某简单微粒的结构示意图为:且X、Y 均为不大于20的正整数,据此回答下列问题:
(1)若该微粒一般情况下不与其它元素的原子反应,这种微粒的符号是
(2)若该微粒有很强的氧化性,且只需得到一个电子就能达到稳定结构,这种微粒的结构示意图为
(3)若该微粒为一价阳离子,且对应的碱为可溶性强碱,则x= y= 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com