
题目列表(包括答案和解析)
4、下列分子中所有原子都满足最外层为8电子结构的是
A.BF3 B.H2O C.SiCl4 D.PCl5
3、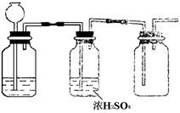 根据实验室制取某种干燥气体的装置图(右图),判断气体发生装置中的固体药品和液体可能是(
)
根据实验室制取某种干燥气体的装置图(右图),判断气体发生装置中的固体药品和液体可能是(
)
A.Zn和稀H2SO4 B.Na2SO3固体和浓H2SO4 C.FeS和稀HCl D.MnO2和浓HCl
2、下列各组粒子中属于同位素的是
A.16O和18O B.H2O和D2O C.H2、D2 D.24Mg和24Na
1、现有以下几种措施:①对硫酸工业产生的尾气进行吸收处理,②对煤进行脱硫处理,③燃煤时鼓入足量空气,④开发清洁能源。其中能减少酸雨产生的措施的
A.①②③ B.②③④ C.①②④ D.①②③④
21.(1)H-H的键能为436kJ/mol。它所表示的意义是形成1molH-H键所 ▲ (填“吸收”或“释放”)的最低能量为436kJ,反之如果要使1molH-H键断裂则 ▲ (填“吸收”或“释放”)能量。
(2)白磷P4(图1)是正四面体构型的分子,当与氧气作用时,每两个磷原子之间插入一个氧原子,此外每个磷原子又以双键再结合一个氧原子形成P4O10(图3)。如图:
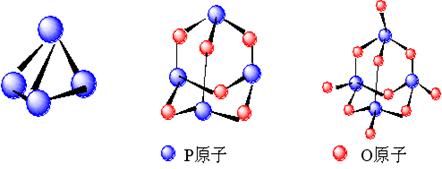
图1(P4) 图2(P4O6) 图3(P4O10)
化学反应本质是旧键断裂和新键的形成。
现提供以下化学键的键能(kJ/mol):P-P键:198 kJ/mol;P-O键:360 kJ/mol;
O=O键:498 kJ/mol;P=O键:585 kJ/mol;
试根据这些数据,通过计算,判断反应:P4+5O2=P4O10是吸热反应还是放热反应,吸收或者放出热量的值是多少?
20.图表法、图象法是常用的科学研究方法。
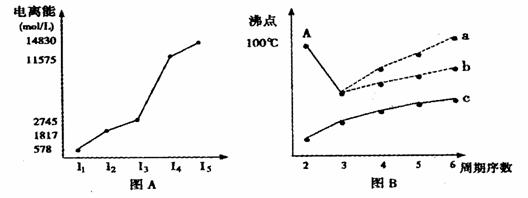
(1)短周期某主族元素M的逐级电离能如图(A)所示,则M元素位于周期表的第 ▲ 族。
(2)图B是研究部分元素的氢化物的沸点变化规律的图像,折线c可以表达出第 ▲ 族元素氢化物的沸点的变化规律。不同同学对某主族元素氢化物的沸点的变化趋势画出了两条折线--折线a和折线b,你认为正确的是: ▲ ,理由是: ▲ 。
(3)下表列出了一些共价键的键长
|
|
C-F |
C-Cl |
C-Br |
C-I |
C-C |
C-Si |
|
键长/pm |
98 |
161 |
182 |
204 |
154 |
170 |
则CF4、CCl4、CBr4、CI4四种物质中热稳定性最强的是 ▲ ,沸点最高的是 ▲ 。
19.有下列物质:①HF ②Cl2 ③H2O ④N2 ⑤C2H4 ⑥C2H6 ⑦H2 ⑧H2O2 ⑨HCN
(1)只含极性键的是 ▲ ;既含极性键又含非极性键的是 ▲ ;
(2)只有σ键的是 ▲ ;既有σ键,又有π键的是 ▲ ;
(3)含有由一个原子的s轨道与另一个原子的p轨道重叠形成的σ键的是 ▲ ;
含有由一个原子的p轨道与另一个原子的p轨道重叠形成的σ键的是 ▲ 。
18.1994年度诺贝尔化学奖授予为研究臭氧作出特殊贡献的化学家。O3能吸收有害紫外线,保护人类赖以生存的空间。O3分子的结构如图,呈V型,键角116.5℃。三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键--三个O原子均等地享有这4个电子。请回答:
 |
|
O3的分子结构 |
(1)题中非极性键是 ▲ 键,特殊的化学键是 ▲ 键(填σ或π)
(2)选出下列分子与O3分子的结构最相似的的是 ▲ 。 A.H2O B.CO2 C.SO2 D.BeCl2
(3)分子中某原子有1对没有跟其他原子共用的价电子叫孤对电子,那么O3分子有 ▲ 对孤对电子。
(4)O3分子是否为极性分子 ▲ (填是或否)。
(5)O3与O2间的转化是否为氧化还原反应 ▲ (填是或否)。
17.下图是元素周期表中的一部分,表中所列字母分别代表一种化学元素,
|
A |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
B |
|
|
C |
|
|
|
|
|
|
|
|
|
|
|
M |
D |
E |
|
|
|
F |
|
|
|
|
|
|
|
|
|
|
|
G |
|
|
H |
I |
|
|
|
|
|
|
|
N |
|
J |
|
|
|
|
|
|
|
|
|
|
|
K |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
L |
|
请回答下列问题:
(1)上述所列元素的原子中,最外层电子层上只有两个电子的是 ▲ (填“元素符号”);按电子排布,可把元素划分成5个区,不全是金属元素的区为 ▲ 。
(2)下列叙述正确的是 ▲ (填字母序号);
a.K的最高价氧化物对应的水化物是一种强碱
b.硒化氢的稳定性强于H的氢化物的热稳定性
c.A和E形成的化合物中只含极性键不可能含非极性键
d.MA2E分子中M原子采取SP2杂化方式
e.N的电子排布式:ls22s22p63s23p63d44s2
f.C与G金属性质相似,单质或其氢氧化物既能与盐酸反应,又能与氢氧化钠溶液反应
(3)画出D的基态原子的原子轨道表示式 ▲ 。
(4)以上元素中, ▲ (填元素符号)元素原子失去核外第一个电子需要的能量最多。
(5)根据VSEPR理论预测DA4+离子的空间构型 ▲ ;ME2的空间构型 ▲ 。
(6)N的一种化合物CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是 ▲ (填“极性”或“非极性”)分子。
16.A、B、C、D、E是相邻三个周期中的五种元素,它们的原子序数依次增大,B、C、D属同一周期,A、E在周期表中处于同一纵行。己知:
①除A外,各元素原子的内层均已填满电子,其中B的最外层有4个电子;
②A与B,B与C都能生成气态非极性分子的化合物;
③D与E生成离子化合物,其离子的电子层结构相同。回答:
(1) 书写A、B、C、D的元素符号 ▲ 。
(2) C元素在周期表中的位置 ▲ ,原子结构示意图为 ▲ 。
(3) 用电子式表示D与E形成化合物的过程 ▲ ;
D与B形成的化合物的电子式 ▲ 。
(4)由以上元素组成的既含离子键又含极性键的化合物的电子式 ▲ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com