
题目列表(包括答案和解析)
20.(8分) 印刷电路板是由高分子材料和铜箔复合而成,刻制印刷电路时,用200 mL FeCl3溶液作为“腐蚀液”,生成CuCl2和FeCl2。化学兴趣小组的同学为分析某厂家腐蚀后所得混合溶液的组成,进行了有关探究。根据有关数据,回答问题:(反应前后溶液的体积变化忽略不计)
(1) 取50.0 mL反应后的混合溶液中加入足量的AgNO3溶液,析出86.1 g沉淀。则该厂所使用的FeCl3溶液的物质的量浓度是多少?
▲
(2)另取50.0 mL反应后的混合溶液中试探性地加入1.40 g铁粉,结果铁粉全部溶解且未见固体析出。再向反应后的溶液中加入足量的稀硝酸,结果放出1.12 LNO(标准状况)。200 mL FeCl3溶液腐蚀掉铜的质量是多少?(提示:发生如下反应3Fe2++4H++NO3-=3Fe3++NO↑+2H2O)
▲
19.(10分)明矾[KAl(SO4)2·12H2O ]是无色晶体,可溶于水,常用作净水剂。某研究小组通过下列流程用明矾来制取硫酸钾,试根据操作流程回答有关问题:

(1)明矾在天然水中生成 Al(OH)3 (胶体), Al(OH)3可以和悬浮于水中的泥沙形成絮状不溶物沉降下来,使水澄清。可利用 ▲ 来区分胶体和溶液。
(2)明矾溶液与a反应,该反应的化学方程式是 ▲ 。
(3)物质b的化学式是 ▲ ;加入过量c的目的是 ▲ 。
(4)操作①的名称是 ▲ ;操作②和③中都需用到的玻璃仪器是 ▲ 。
(5)若用94.8 g 明矾(相对分子质量474)进行上述实验,理论上至少可以制得 ▲ g硫酸钾晶体。
18.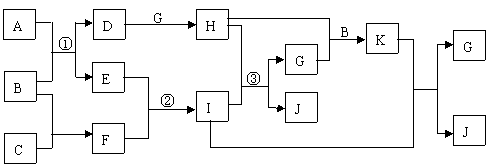 (10分)下列为中学化学常见物质的相互反应关系图(生成物中H2O 均未列出)。A、B、C、G都属于氧化物,A为固体、B为液体、C、E、G为气体,C是主要的大气污染物,F与I的摩尔质量相差16,D、H、J、K的焰色反应呈黄色。
(10分)下列为中学化学常见物质的相互反应关系图(生成物中H2O 均未列出)。A、B、C、G都属于氧化物,A为固体、B为液体、C、E、G为气体,C是主要的大气污染物,F与I的摩尔质量相差16,D、H、J、K的焰色反应呈黄色。
(1)写出有关物质的化学式:C ▲ 、G ▲ 。
(2)分别写出反应①、②的化学方程式:
① ▲ ;② ▲ 。
(3)写出反应③的离子反应方程式: ▲ 。
(4)将物质K转化为物质H的方法是 ▲ 。
17.(6分)禽流感病毒是一种没有超常抵抗力的病毒。漂白粉是常用的消毒剂,可以将禽流感病毒杀灭。
(1) 漂白粉的有效成分是 ▲ (填化学式)。
(2) 漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为 ▲ 。
 (3)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉。实验室用二氧化锰和浓盐酸反应制取氯气:MnO2
+4HCl (浓) MnCl2
+2H2O +Cl2 ,该反应中,氧化剂是 ▲ ,每生成1molCl2,转移电子总数为 ▲ mol。
(3)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉。实验室用二氧化锰和浓盐酸反应制取氯气:MnO2
+4HCl (浓) MnCl2
+2H2O +Cl2 ,该反应中,氧化剂是 ▲ ,每生成1molCl2,转移电子总数为 ▲ mol。
16.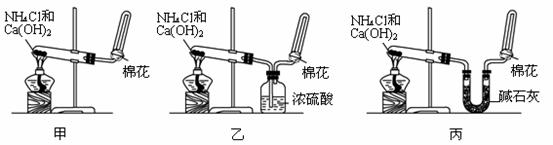 (10分) 甲、乙、丙三位同学分别用如下三套实验装置及化学药品(其中碱石灰为固体氢氧化钠和生石灰的混合物)制取氨气。
(10分) 甲、乙、丙三位同学分别用如下三套实验装置及化学药品(其中碱石灰为固体氢氧化钠和生石灰的混合物)制取氨气。
请你参与研究,并回答有关问题:
(1)三位同学所用化学药品制取氨气的化学方程式为
▲ 。
(2)三位同学都用向下排空气法而不用其他实验室常用方法收集氨气,其原因是 ▲ 。
(3)三位同学用上述装置制取氨气时,其中有一位同学没有收集到氨气,如果他的实验操作都正确,你认为没有收集到氨气的同学是 ▲ 填(“甲”、“乙”或“丙”),收集不到氨气的主要原因是 ▲ 。
(4)你检验氨气是否收集满的方法是(简述操作方法、现象和结论)
▲ 。
(5)三位同学都认为他们的实验装置也可用加热碳酸氢铵固体制取氨气,你判断他们能够达到实验目的的是 ▲ (填“甲”、“乙”或“丙”),其理由是 ▲ 。
15. (8分)某校课外活动小组同学需要250 mL 1.00 mol/L H2SO4 溶液进行探究实验。实验室现有下列化学试剂和仪器:密度为1.84g/cm3浓度为18.4mol/L的浓硫酸、蒸馏水; 玻璃棒、烧杯、 试管、10mL量筒、50mL量筒、250 mL烧瓶 。
(1) 配制溶液时,除上述仪器外还需要的仪器是 ▲ (写仪器名称)。
(2)计算需要浓硫酸的体积为 ▲ 。
(3)溶液配制过程中,使用玻璃棒的两处操作分别是 ▲ 。
(4)小明将洗涤烧杯的溶液倒入水池,这种错误操作的后果是 ▲ 。
14.将50 mL 0.5 mol/L的氯化铝溶液加入4. 0mol/L的氢氧化钠溶液可得到1.56g沉淀,则消耗氢氧化钠溶液的体积是
A.15 mL B.20 mL C.30 mL D.45 mL
第Ⅱ卷(非选择题 共52分)
13.工业废气中氮氧化物是主要的大气污染源之一。
已知2NO2+2NaOH=NaNO3+NaNO2+H2O, NO2+NO+2NaOH=2NaNO2+H2O。
现有a mol NO2和b mol NO的混合气,若用足量的NaOH溶液将其完全吸收,则混合气中两种气体的物质的量必须满足的关系是
A.a=b/3 B.2a=b C.a≥b D.a<b
12.下列有关元素化合物的叙述中正确的是
A.钠在空气中燃烧生成白色的氧化钠固体
B.检验FeCl2溶液中的少量Fe3+,可以用KSCN溶液
C.氯水中加入有色布条后,HClO可以使有色布条褪色
D.普通玻璃的组成可用Na2O·CaO·6SiO2表示,是纯净物
11.下列除去杂质的实验方法正确的是
A.除去CO中少量O2:通过灼热的Cu网后收集气体
B.除去K2CO3固体中少量NaHCO3:置于坩埚中加热
C.除去KCl溶液中的少量MgCl2:加入适量NaOH溶液,过滤
D.除去CO2中的少量HCl:通入饱和NaHCO3溶液,收集气体
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com