
题目列表(包括答案和解析)
2.下列反应中属于氧化还原反应的是
A.CO2+H2O==H2CO3 B.CO2+C 2CO
2CO
C.CaCO3+2HCl==CaCl2+H2O+CO2↑ D.H2CO3==CO2↑+H2O
1.关于摩尔的叙述中正确的是
A.摩尔是物质质量的单位
B.摩尔是物质数量的单位
C.摩尔既表示物质微粒数量,又表示物质质量,是具有双重意义的单位
D.摩尔是物质的量的单位,每摩尔物质含有阿伏加德罗常数个微粒
31.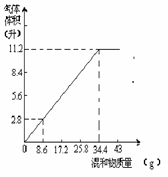 (8分)在100ml NaOH溶液中加入NH4NO3和(NH4)2SO4的固体混合物,加热充分反应。右图表示加入的混合物质量和产生的气体体积(标准状况)的关系,试计算:
(8分)在100ml NaOH溶液中加入NH4NO3和(NH4)2SO4的固体混合物,加热充分反应。右图表示加入的混合物质量和产生的气体体积(标准状况)的关系,试计算:
(1)NaOH溶液的物质的量浓度 。
(2)当NaOH溶液的体积为140mL,固体混合物质量是51.6g时,充分反应后,生成气体的体积为 。
(3)当NaOH溶液体积为180mL时,固体混和物的质量为51.6g时,充分反应后,生成气体的体积为 。
30.(2分)向一定量的 FeO、Fe、Fe3O4 和Fe2O3的混合物中加入1mol·L-1的盐酸200ml,恰好使混合物完全溶解,放出224ml(标准状况)的气体,在所得溶液中加入KSCN溶液无血红色出现.若用足量的CO在高温下还原相同的质量的此混合物,能得到铁的质量
是 g?
29.(4分)(1)某金属氯化物MCl2 40.5 g,含有0.600mol Cl-,则该氯化物的摩尔质量为 ,金属M的相对原子质量为 。
(2)、生物上用高速离心机分离细胞各组分时需要使用蔗糖(C12H22O11)溶液。若某蔗糖溶液的物质的量浓度为3.20mol·L-1,那么 升这样的溶液含137g蔗糖?
28.(6分)SO2是一种酸性氧化物,能与氢氧化钠溶液反应。反应产物与反应物的量有关,当SO2过量时,生成NaHSO3,当氢氧化钠过量时,生成Na2SO3。
(1)请写出上述反应的化学方程式。
(2)某硫酸厂每天排放1.0×104m3(标准状况)尾气,其中含0.2%(体积分数)的SO2,现欲用2.0mol/L氢氧化钠溶液进行处理,每天至少需氢氧化钠溶液多少升?
(注:1L=1dm3)
27、(10分)为探究CO2与过量的NaOH溶液确实发生了化学反应,甲、乙、丙三位同学设计了下列三种实验装置,请回答下列问题:
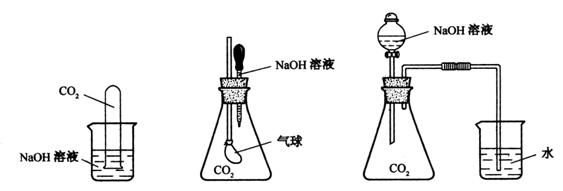 (甲) (乙)
(丙)
(甲) (乙)
(丙)
(1)请写出CO2与过量的NaOH发生反应的化学方程式: 。
(2)选择任意一种实验装置,简述预计出现的实验现象,解释产生该实验现象的原因。你选择的实验装置是 ,实验现象是 。 解释产生该实验现象的原因 。
(3)甲、乙、丙同学设计的三个方案中,有一个方案在实际操作中可行性和安全性存在问题,该方案是 。(填甲、乙或丙)
(4)请设计一个实验检验生成的产物中含有Na2CO3。(简述所用试剂、实验现象和结论。)
26.(12分)化学实验室产生的废液中含有大量会污染环境的物质,为了保护环境,化学实验室产生的废液必须经处理后才能排放。某化学实验室产生的废液中含有Fe3+、Cu2+、Ag+三种金属离子,实验室设计了下列方案对废液进行处理:

(1)废液经操作①得到的沉淀中含有的金属单质是 ;
写出操作①的反应离子方程式 ; ; 。
(2)在操作②中观察到的实验现象是
(3)操作③中发生主要反应的离子方程式为
25、(12分)氯碱工业中,通过电解饱和食盐水获得重要的化工原料:氯气、氢气和氢氧化钠。其中氯气用途十分广泛,除用于净水、环境消毒外,还用于生产盐酸、硅、聚氯乙烯、氯苯等。
(1)写出氯碱工业中通过电解饱和食盐水获得重要的化工原料氯气的离子方程式
(2)工业上可用氯气和石灰乳为原料制造漂白粉,写出该反应的化学方程式 。
(3)工业上生产半导体材料硅的流程如下:

①写出在制备粗硅时反应的化学方程式_____________________________,在该反应的化学方程式上标出电子的转移方向和数目。此反应中焦炭的作用是____________。(填“氧化剂”或“还原剂”) ②粗硅与氯气反应后得到沸点较低的液态四氯化硅中常混有一些高沸点,难挥发性杂质,必须进行分离提纯。其提纯方法为____________。(填序号)
A.蒸馏 B.过滤 C.萃取 D.结晶 ③由四氯化硅通入氢气得到高纯硅和氯化氢气体,写出该反应的化学方程式:
________________________________________________________________________。
24.(10分)实验室配制0.5mol·L-1的KCl溶液500mL,有以下仪器:
①烧杯 ②胶头滴管 ③1000mL容量瓶 ④500mL容量瓶 ⑤玻璃棒
⑥托盘天平(带砝码) ⑦酒精灯 ⑧量筒
(1)配制时,称量时必须使用的仪器有 (填代号)
(2)该实验两次用到玻璃棒,其作用分别是 、
(3)配制时一般可分为以下几个步骤:①称量 ②计算 ③溶解 ④转移 ⑤洗涤
⑥定容 ⑦摇匀(要用到两次) ⑧冷却
其正确的操作顺序为②①③ ⑦⑥
(4)试计算应称取的KCl固体的质量为 g。在定容时视线应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com