
题目列表(包括答案和解析)
1.加快反应速率可以采取的方法是
A.升高温度 B.减小压强 C.降低温度 D.减小反应物浓度
32.已知将盐酸逐滴加入Na2CO3 溶液中发生如下反应:
Na2CO3 + HCl ═ NaHCO3 + NaCl ; NaHCO3 +HCl ═ NaCl + CO2↑+ H2O
若将Na2CO3 溶液逐滴加入盐酸中,则发生如下反应:
Na2CO3 + 2HCl ═ 2NaCl + CO2↑+ H2O
现有两瓶溶液,已知它们是Na2CO3 溶液和盐酸溶液,但不知哪瓶是Na2CO3 哪瓶是盐酸,有一同学做如下实验:将两瓶溶液编A号、B号,若将20 mL 的A溶液逐滴加到30 mL 的B溶液中,结果产生112 mL 的CO2 气体。若将30 mLB溶液逐滴加到的20 mL 的A溶液中,结果产生224 mL 的CO2 气体。则
(1)A是 溶液 , B是 溶液
(2)A和B的物质的量浓度各为多少 mol·L―1
 厦门市2007-2008学年(上)高一质量检测
厦门市2007-2008学年(上)高一质量检测
31.下列中学化学中常见物质的转化关系图中,反应条件及部分反应物和产物未全部注明,已知A、D为金属单质,其他为化合物。试推断:
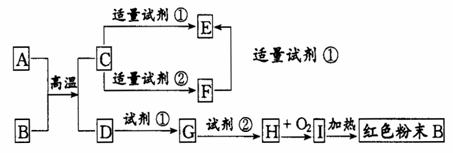
(1)写出物质的化学式:
A:____ ____ B: C: _______ I:________
(2)写出下列反应的方程式:
C→ F的离子方程式
H→ I的化学方程式
30.(16分)小明很喜欢化学实验课,今天要学习“探究铁及其化合物的氧化性或还原性”,现邀你一起走进他的化学课堂。
⑴ 课前老师布置了下列预习作业,请你一起完成:
① 铁不同价态的物质各写一种(并标出铁元素的化合价):
、 、
② 写出一个他们之间相互转化(含三种价态)的化学方程式:
⑵ 实验室提供的下列试剂:锌粒、铁粉、0.1mol·L-1FeCl3溶液、0.1mol·L-1FeCl2溶液、KSCN溶液、新制氯水,探究Fe2+ 、Fe3+ 的氧化性、还原性。
根据氧化还原的有关原理,小明说Fe2+既有还原性又有氧化性; 为证实自己的假设,请你和小明一起设计实验方案,进行实验并描述实验现象,完成下列表格。
|
探究内容 |
实验方案 |
实验现象 |
|
探究Fe2+具有还原性 |
|
|
|
探究Fe2+具有氧化性 |
|
|
⑶ 小明家有一瓶近无色的补血剂,请你设计一个实验方案,检验其中铁元素的价态。
29.将2 mol NaHCO3和一定量的Na2O2 固体混合,在加热条件下让其充分反应后,对所得固体进行测定,发现Na2O2无剩余,则所得固体的物质的量(n)为
A.1 mol < n < 2 mol B.1 mol ≤ n < 4 mol
C.2 mol < n < 4 mol D. 1 mol < n ≤ 4 mol
28.某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定ClO-与ClO3-的浓度之比为1∶3,则与溶液反应时被还原的氯元素与被氧化的氯元素的物质的量之比为
A.21∶5 B.11∶3 C.4∶1 D.3∶1
27.除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作: ①过滤;②加过量的氢氧化钠溶液;③加适量的盐酸;④加过量的碳酸钠溶液;⑤加过量的氯化钡溶液。下列正确的操作顺序是
A.①④②⑤③ B.②⑤④①③ C.⑤②①④③ D.④①②⑤③
26.设NA代表阿佛加德罗常数,下列说法正确的是
A.22.4LCO和CO2的混合气体中所含的碳原子数一定是NA
B.含1mol HCl的盐酸溶液与足量Fe反应,Fe所失去的电子总数为2NA
C.常温常压下,32g O2和32g O3所含氧原子数都是2NA
D.标准状况下,11.2L H2O含有0.5NA分子
25.在无色溶液中,下列离子能大量共存的是
A.Mg2+、SO42-、K +、Cl- B.Na+ 、NH4+ 、NO3-、MnO4-
C.K + 、Cu2+ 、Cl-、Br- D.Ba2+ 、Na+ 、OH-、HCO3-
24.下列化学方程式中,可用离子方程式2H++CO32-= CO2↑+H2O表示的是
A.稀硫酸中滴加小苏打溶液 B.稀盐酸中滴加纯碱溶液
C.稀盐酸与石灰石反应 D.从草木灰中提取的碳酸钾与足量醋酸反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com