
题目列表(包括答案和解析)
13、下列变化是因原电池反应而引起的是
A、在空气中金属铝表面迅速氧化形成保护膜
B、常温下,铁被浓硫酸“钝化”形成保护膜
C、在潮湿的空气中钢铁易生锈 D、在潮湿的空气中过氧化钠易变质
12、化学反应的特征是
A、发光发热 B、能量发生变化 C、状态发生变化 D、有新物质生成
11、下列变化一定是吸热反应的是:
A、凡需加热后才能发生的反应 B、所有的分解反应
C、将热能转变为化学能的反应 D、生成物总能量大于反应物总能量的反应
10、将煤块粉碎、经脱硫处理、在适当过量的空气中燃烧,这样处理的目的是
①使煤充分燃烧,提高煤能的利用率 ②减少SO2的产生,避免造成“酸雨”③减少有毒的CO产生,避免污染空气 ④减少CO2的产生,避免“温室效应”
A、①②③ B、②③④ C、①③④ D、①②③④
9、 已知可逆反应2SO2 + O2 2SO3,当生成2 mol SO3时放出热量为Q,
已知可逆反应2SO2 + O2 2SO3,当生成2 mol SO3时放出热量为Q,
 现将1 mol SO2和0.5 mol O2在相同条件下反应生成SO3放出的热量为Q1,则
现将1 mol SO2和0.5 mol O2在相同条件下反应生成SO3放出的热量为Q1,则
A、Q1 = Q B、Q1 < Q C、2Q1 > Q D、无法判断
8、将1mol N2和3 mol H2通入4L的密闭容器中反应,半分钟后测得H2的物质的量为2.1 mol,现用如下三种物质在单位时间内的浓度变化来表示该反应速率。① Ʋ(N2) = 0.15 mol/(L·min) ② Ʋ(N2) = 1.05 mol/(L·min)
③ Ʋ(NH3) = 0.30 mol/(L·min) 其中正确的是
A、①② B、②③ C、①③ D、①②③
7、可逆反应2SO2
+ O2 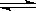 2SO3达到平衡的标志是
2SO3达到平衡的标志是
① 消耗2 mol SO2的同时生成2 mol SO3
② SO2、O2与SO3的物质的量之比为2∶1∶2
③ 反应混合物中,SO3的质量分数不再改变
A、①② B、①③ C、只有③ D、只有①
6、在反应:C + CO2 ≒ 2CO中,可使反应速率增大的措施是:
①增大压强 ②升高温度 ③通入CO2 ④增加碳的量 ⑤降低压强
A、①②③④ B、②③④⑤ C、①②③ D、②③④
5、X,Y,Z都是金属,在X与稀H2SO4反应中,加入少量Z的硫酸盐溶液时能使反应加快;X与Y组成原电池时,Y电极质量减少,X,Y,Z三种金属的活动性顺序为:
A、X>Y>Z B、X>Z>Y C、Y>X>Z D、Y>Z>X
4、氢氧燃料电池是一种高效、环境友好的发电装置,它是以铂作电极,KOH溶液作电解液,总反应为:2H2 + O2 = 2H2O,正极反应为:O2 + 2H2O + 4e- = 4OH-下列叙述不正确的是
A、 H2通入负极区 B、O2通入正极区
C、负极反应为2H2 + 4OH- - 4e- = 4H2O D、正极发生氧化反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com