
题目列表(包括答案和解析)
23.(4分)以锌、石墨棒为两极,硫酸铜溶液为电解液组成的原电池的正极反应式是
负极反应式是 。
22.(4分)指出下列变化能量是怎样转化的:
(1)学校燃烧煤煮饭 ,(2)给手机的电池充电 ,(3)用畜电池点亮灯泡 ,
(4)电解水得到O2和H2 。
21.(8分)由铜、锌和稀盐酸组成的原电池中,铜是 极,发生 反应,电极反应式是 ;锌是 极,发生 反应,电极反应式是 。
20.(3分)已知拆开1 mol H-H键、1 mol I-I、1 mol H-I键分别需要吸收的能量为436kJ、151k J、299k J。则由氢气和碘反应生成1 mol HI需要 (填“放出”或“吸收”) k J的热量。
19、在一个密闭容器中,盛有N2和H2,它们的起始浓度分别是1.8 mol·L-1和5.4 mol·L-1,在一定的条件下它们反应生成NH3,10min后测得N2的浓度是0.8 mol·L-1,则在这10min内NH3的平均反应速率是
A、0.1mol.L-1.min-1 B、0.2mol.L-1.min-1 C、0.3mol.L-1.min-1 D、0.6mol.L-1.min-1
18、下列实验中,反应速率加快是由催化剂引起的是:
A、在炭粉中加入KClO3,点燃时燃烧更为剧烈
B、锌与稀硫酸反应中加入少量CuSO4溶液而使反应放出H2的速率加快
C、固态FeCl3和固体NaOH混合后,加入水能迅速产生沉淀
D、双氧水中加入少量MnO2,即可迅速放出气体
17、一定温度下可逆反应N2(g) + 3H2(g) ≒ 2NH3(g)达平衡的标准是:(分别用V表示正反应速率,V╯表示逆反应速率)
A、V(N2) = V╯(N2) B、V(N2) = 3V(H2)
C、V(H2) = 3/2V╯(NH3) D、N2,H2,NH3的体积比为1:3:2
16、金刚石和石墨都是碳的单质,石墨在一定条件下可以转化为金刚石并需要吸收能量。已知12g石墨或金刚石完全燃烧时放出的热量依次为Q1和Q2,下列说法错误的是
A、Q1 < Q2 B、石墨不如金刚石稳定
C、石墨具有的能量比金刚石低 D、石墨与金刚石完全燃烧,生成的二氧化碳一样多
15、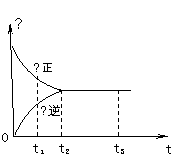 右图是可逆反应X2 + 3Y2
右图是可逆反应X2 + 3Y2  2Z2 在反应
2Z2 在反应
过程中的反应速率(Ʋ)与时间(t)的关系曲线,
下列叙述正确的是
A、t1时,只有正方向反应
B、t2时,反应到达限度
C、t2- t3,反应不再发生
D、t2- t3,各物质的浓度不再发生变化
14、下列措施对增大反应速率明显有效的是:
A、Na与水反应时增大水的用量 B、Fe与稀硫酸反应制取氢气时,改用浓硫酸
C、在K2SO4与BaCl2两溶液反应时,增大压强
D、将铝片改为铝粉,做铝与氧气反应的实验
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com