
题目列表(包括答案和解析)
7、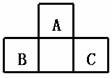 A、B、C均为短周期元素,它们在周期表中的位置如下图.已知B、C两元素在周期表中族序数之和是A元素序数的2倍;B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C 所在的一组是( )
A、B、C均为短周期元素,它们在周期表中的位置如下图.已知B、C两元素在周期表中族序数之和是A元素序数的2倍;B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C 所在的一组是( )
A. Be、Na、Al B.B、Mg、Si C.O、P、Cl D.C、Al、P
6、某阳离子ARn+,核外共有x个电子,则该原子核内质子数、中子数分别为:
A.(n+x)、(A-n+x) B.(A-n)、(n-x-A)
C.(n+x)、(A-n-x) D.(x-n)、(A-x+n)
5、下列叙述中正确的是: A.阳离子一定是金属离子, 阴离子一定只含有非金属元素 B.某金属元素的阳离子和某非金属元素的阴离子组成的物质一定是纯净物 C.阴阳离子相互作用后一定形成离子化合物 D.金属K不可能从盐的水溶液中置换出金属单质
4、某元素的最外层有2个电子, 该元素:
A. 一定是金属元素 B. 最高化合价一定为 +2 价 C. 一定是 ⅡA 族元素或是 He D. 无法确定属于哪类元素
3、下列关于物质性质变化的比较, 不正确的是:
A. 酸性强弱: HI > HBr > HCl > HF B. 原子半径大小: Na > S > O C. 碱性强弱: KOH > NaOH > LiOH D. 还原性强弱: F- > Cl- > I-
2、以下互称为同位素的是:
A.金刚石和石墨可互称为同位素
B.氰酸铵(NH4CNO)和尿素[CO(NH2)2]是同分异构体
C.D2和T2 可互称为同素异形体素
D.1H216O和2H218O是同素异形体
1、元素性质呈周期性变化的决定因素是( )
A.元素原子半径大小呈周期性变化 B.元素原子量依次递增
C.元素原子最外层电子排布呈周期性变化 D.元素的最高正化合价呈周期性变化
23、(6分) (1)在标准状况下,将4.2gNaHCO3和过量的200ml HCl制CO2,理论上制备CO2多少L?
(已知:NaHCO3+ HCl=NaCl+ H 2 O+ CO2 ↑)
(2)实际上由于一部分CO2溶解在反应后的混和溶液中,收集的CO2气体减少,已知每升溶液能溶解CO2 1.2L,则实际收集CO2多少升?(假设溶液体积变化忽略不计)
(3)如果某学生将实际质量为13.2g的NaHCO3错误地放在托盘天平的右盘上进行称量(5克以下用游码),根据他的称量结果进行计算,这些NaHCO3加热分解放出CO2的物质的量为多少?
※24.(6分)取软锰矿17.4g(主要成分为MnO2,其杂质不与浓盐酸反应)与足量的浓盐酸反应后,将生成的Cl2通入到200mL NaBr溶液中(其中含22g NaBr),经加热蒸发水分并烘干后,得到质量为13.1g的残渣。试计算:
(1)通入Cl2后,溶液中NaCl的物质的量浓度(忽略溶液的体积变化)
(2)软锰矿中MnO2的质量分数
卤素 垫江师范学校高2010级高一上期化学练习试卷3卤 素(四)
22、(3分)一定量的氢气在氯气中燃烧,所得混合物用100 mL 3.00 mol/L的NaOH溶液(密度为1.12 g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500 mol。(2007年高考上海化学卷)
(1)原NaOH溶液的质量分数为 。
(2)所得溶液中Cl-的物质的量为 mol。
(3)所用氯气和参加反应的氢气的物质的量之比n(Cl2):n(H2)= 。
21、为检验某碳酸钠溶液中混有的溴化钠,进行如下实验:(4分)
|
实验步骤 |
实验现象 |
简 答 |
|
取样,加入过量的稀硝酸 |
|
加硝酸的目的是:
|
|
加入硝酸银溶液 |
|
反应的化学方程式为:
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com