
题目列表(包括答案和解析)
28.德国化学家哈因发明了由氮气和氢气合成氨气的方法而获得了1918年诺贝尔化学奖。现向一密闭容器中充入1 mol N2和3 mol H2,在一定条件下使该反应发生。下列说法正确的是: ( )
A.达到平衡时,氮气将完全转化为氨气
B.达到化学平衡时,氮气、氢气和氨气的浓度一定相等
C.达到化学平衡时,氮气、氢气和氨气的浓度不再变化
D.达到化学平衡时,正反应和逆反应的速率相等且为零
27.为了说明影响化学反应快慢的因素,甲、乙、丙、丁4位同学分别设计了如下4个试验,你认为结论不正确的是: ( )
A.将形状、大小均相同的镁条和铝条与相同浓度的盐酸反应时,两者速率一样大
B.在相同条件下,等质量的大理石块和大理石粉末与相同浓度的盐酸反应,大理石粉末反应快
C.将浓硝酸分别放在冷暗处和强光照射下,会发现光照可以加快浓硝酸的分解
D.2只试管中分别加入相同质量的氯酸钾,其中一只试管中再加入少量二氧化锰,同时加热,产生氧气的快慢不同
26.下列每组物质发生状态变化所克服的粒子间的相互作用属于同种类型的是: ( )
A.食盐和蔗糖熔化 B.钠和硫熔化
C.碘和干冰升华 D.二氧化硅和氧化钠熔化
25.(10分)1932年美国化学家鲍林(L.Pauling)首先提出了电负性的概念。电负性(用X表示)也是元素的一种重要性质,下表给出的是原子序数小于20的16种元素的电负性数值:
|
元素 |
H |
Li |
Be |
B |
C |
N |
O |
F |
|
电负性 |
2.1 |
1.0 |
1.5 |
2.0 |
2.5 |
3.0 |
3.5 |
4.0 |
|
元素 |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
K |
|
电负性 |
0.9 |
1.2 |
1.5 |
1.7 |
2.1 |
2.3 |
3.0 |
0.8 |
请仔细分析,回答下列有关问题:
(1)根据表中所给数据分析,同主族内不同元素X值的变化规律是____从上向下,X值减小__;简述元素电负性X的大小与元素金属性、非金属性之间的关系 元素电负性越大,非金属性越强,金属性越弱,反之亦然。
(2)预测周期表中电负性最大的元素应为 F ,电负性最小的元素为 Cs (放射性元素除外)估计钙元素的电负性的取值范围 0.8 < X < 1.2 。
(3)经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中形成的化学键的类型 为共价键 ,其理由是 因为AlCl3中Cl和Al的电负性差值为1.5,而Br的电负性小于Cl,所以AlBr3中两元素的电负性差值小于1.5。
B卷(满分50分)
24.(9分)无水氯化铝是白色晶体,易吸收水分,在178℃ 升华,装有无水氯化铝露置于潮湿空气中会爆炸并产生大量白雾,工业上由金属与氯气作用或由无水氯化氢气体与熔融Al作用而制得,某课外活动小组在实验室内通过下列装置(如下图)制取少量纯净的无水氯化铝。
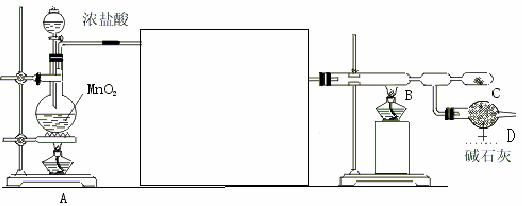
试回答以下问题:
(1)装置A中反应的化学方程式 MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O
。
MnCl2+Cl2↑+2H2O
。
(2)为使实验成功,A和B间需要加适当的装置,请将它画在框内,并注明其中盛放的药品。如果A产生的气体直接进入B中,实验产生的不良后果是
AlCl3与H2O反应而爆炸
答案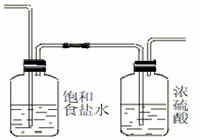
(3)进行实验时,应先点燃(填写字母,下同) B 处的酒精灯,然后再点燃
A 处的酒精灯。
(4)在C处可以收集到纯净的氯化铝,原因是 AlCl3易升华 。
(5)装置D的作用是 吸收多余的Cl2且防止水蒸气进入C使AlCl3发生水解
23.(6分)某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
|
时间(min) |
1 |
2 |
3 |
4 |
5 |
|
氢气体积(mL) |
50 |
120 |
232 |
290 |
310 |
① 哪一时间段(指0-1、1-2、2-3、3-4、4-5 min)反应速率最大 2-3 min ,原因是
因该反应是放热反应,此时温度高。
② 哪一段时段的反应速率最小 4-5 min ,原因是因为此时H+ 浓度小
③ 如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液:A 蒸馏水、B NaCl溶液、C NaNO3溶液、D CuSO4溶液、E Na2CO3溶液,你认为可行的是 A、B 。
22.(3分)王亮在超市看到一种电池外壳的纸层包装印有右图的文字,请根据要求回答问题。
(1)该电池的种类是__①____(填序号)。
①干电池 ②蓄电池 ③燃料电池
(2)该电池含有的金属元素中毒性最大的是__Hg____(写元素符号)。
(3)该电池的使用和性能,说法正确的是__A___
A.该电池可应用于闹钟、收音机、照相机等
B.该电池可充电后反复使用
C.该电池使用后不能投入火中,应埋入地下以防污染环境
21.(9分)有A、B、C、D四种短周期元素, 它们的原子序数由A到D依次增大, 已知A和B原子有相同的电子层数, 且A的L层电子数是K层电子数的两倍, C燃烧时呈现黄色火焰, C的单质在高温下与B的单质充分反应, 可以得到与D单质颜色相同的淡黄色固态化合物, 试根据以上叙述回答:
(1)元素名称: A 碳、 B _氧、__ C ___钠、_ D ___硫__
(2)写出AB2与氢氧化钠反应的离子方程式 __ CO2+2OH-=H2O+CO32- 。
(3)画出D的原子结构示意图 __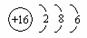 _____, 用电子式表示化合物 C2D
的
_____, 用电子式表示化合物 C2D
的
形成过程 ______ 。
。
20.(2分) 现有A、B、C、D四种金属,把A、B分别浸入稀硫酸中,产生气泡都很慢;把C、D分别浸入水中都能产生气泡;把A、B用导线连接同时放入装有稀硫酸的烧杯中,A上有大量气泡析出;把C浸入D的硝酸盐溶液中,C的表面有D析出。这四种金属的活动顺序由强到弱为 C>D>B>A 。
19.(7分)(1)下列五种物质中Ne ②H2O ③NH3 KOH Na2O,只存在共价键的是
②③ ,只存在离子键的是 ⑤ ,既存在共价键又存在离子键的是 ④ ,不存在化学键的是 ① 。(填写序号)
(2)在下列变化中,①碘的升华 ②烧碱熔化 ③MgCl2溶于水 ④HCl溶于水⑤O2溶于水,未发生化学键破坏的是 ①⑤ ,仅发生离子键破坏的是 ② ③ ,仅发生共价键破坏的是 ④ 。(填写序号)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com