
题目列表(包括答案和解析)
24、(10分)已知电极材料:铁、铜、银、石墨、锌、铝,电解质溶液:氯化铜溶液、硫酸铁溶液、盐酸。按要求回答下列问题:
①电工操作上规定:不能把铜导线和铝导线连接在一起使用,请说明原因。
。
②若电极材料选铜和石墨,电解质溶液选硫酸铁溶液,外加导线,能否构成原电池? ,若能,请写出电极反应式,负极 ,
正极 。若不能后面两空不填。
 ③有M、N两种金属分别与稀盐酸反应,产生氢气速率相近,请设计一个实验证明M、N两种金属的活泼性
。
③有M、N两种金属分别与稀盐酸反应,产生氢气速率相近,请设计一个实验证明M、N两种金属的活泼性
。
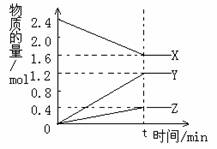
23、(6分)影响化学反应速率的外部因素主要有 、 、 和催化剂等。已知某反应在催化剂作用下按以下两步进行:第一步:X+Y =△= Z
第二步: Y+Z== M+N+X
(1)此反应的总反应式为 _______ (2)反应的中间产物是
(3)反应的催化剂是
22、(6分)把温度为13℃,浓度为1.0mol·L的酸溶液和1.1mol·L的碱溶液各50ml混合[溶液密度均为1g/ml,生成溶液的比热容为4.184J/(g·℃)],轻轻搅动。已知弱酸或弱碱在电离时需要吸收热量。实验中测得酸碱混合液的温度变化数据如下:
|
反应物 |
起始温度t1/℃ |
终了温度t2/℃ |
中和热 |
|
HCl+NaOH |
13 |
19.8 |
Q1 |
|
HCl+NH3·H2O |
13 |
19.3 |
Q2 |
(1)中和热是指酸与碱反应生成1mol H2O时所放出的热量,试计算上述两组实验测出的中和热:Q1= ,Q2= ;
(2)实验中碱液过量的目的是 ;
(3)两组实验结果差异的原因是 。
21、(5分)在下列事实中,什么因素影响了化学反应的速率?
⑴夏天的食品容易霉变,冬天就不容易发生该现象 ;
⑵熔化的氯酸钾放出气泡很慢,撒入少量二氧化锰很快产生气体 ;
⑶工业上常将固体燃料粉碎,以提高燃烧效率 ;
⑷同浓度的硫酸和盐酸与大小且质量相同的锌粒反应,产生气体硫酸快、盐酸慢 ;
⑸集气瓶中H2和Cl2的混合气体,在瓶外点燃镁条时发生爆炸 。
20、将 4 mol A 气体和 2 mol B 气体在 2 L 的容器中混合并在一定条件下发生如下反应
2A(气)+B(气)=2C(气)若经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1 ,现有下列几种说法:① 用物质 A 表示的反应的平均速率为 0.3 mol·L-1·s-1 ② 用物质 B 表示的反应的平均速率为 0.6 mol·L-1·s-1 ③ 2 s 时物质 A 的转化率为70% ④ 2 s 时物质 B 的浓度为 0.7 mol·L-1 其中正确的是
A.①③ B. ①④ C. ②③ D. ③④
请将选择题答案填入下表:
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
|
|
|
|
|
|
|
|
|
|
|
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
|
|
|
|
|
|
|
|
|
|
|
19、一种新型燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极上通乙烷(C2H6)和氧气,其电极反应式为: C2H6+18OH--14e-=2CO32-+12H2O,
2H2O+O2+4e-=4OH-,有关此电池的推断不正确的是
A.电池工作过程中,溶液的pH值逐渐减小 B.通乙烷的电极为负极
C.正极与负极上参加反应的气体的物质的量之比为2 :7
D.正极发生氧化反应
18、同温同压下,当反应物分解了8%时,总体积也增加8%的是

 A.2NH3(g)
? N2(g)+3H2(g)
B.2NO(g) ? N2(g)+O2(g)
A.2NH3(g)
? N2(g)+3H2(g)
B.2NO(g) ? N2(g)+O2(g)

 C.2N2O5(g)
? 4NO2(g)+O2(g)
D.2NO2(g) ? 2NO(g)+O2(g)
C.2N2O5(g)
? 4NO2(g)+O2(g)
D.2NO2(g) ? 2NO(g)+O2(g)
17、有人设计将两根Pt丝做电极插入KOH溶液中,然后在两极上分别通过甲烷和氧气而构成燃烧电池。该电池中反应的化学方程式为:CH4+2O2+2KOH===K2CO3+3H2O,则关于此燃料电池的下列说法错误的是(1个电子所带电量为1.6×10-19C)
A.通过甲烷的电极为电池的负极,通过氧气的电极为正极
B.在标准状况下,每消耗5.6LO2,可向外提供约9.6×104C的电量
C.通过甲烷电极的电极反应为:CH4+10 OH--8e-====CO32- +7H2O
D.放电一段时间后,溶液的pH值升高
16、据最新《参考消息》报道,有科学家提出硅是“21世纪的能源”、“未来的石油”的观点。假如硅作为一种普遍适用的新型能源被开发利用,关于其有利因素的下列说法中,你认为不妥的是
A.硅便于运输、贮存,从安全的角度考虑,硅是最安全的燃料
B.自然界中存在大量的单质硅
C.硅燃烧放出的热量多,且燃烧产物对环境污染程度低,容易有效控制
D.自然界中硅易开采,且可再生
15、在理论上可用于设计原电池的化学反应是
A.Fe+CuSO4=FeSO4+Cu B.HCl+NaOH=NaCl+H2O
C.ICl+H2O=HCl+HIO D.CH4+2O2→CO2+2H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com