
题目列表(包括答案和解析)
9、CuS和Cu2S都能溶于硝酸,它们高温灼烧的产物相同,以下鉴别CuS和Cu2S两种黑色粉末的方法合理的是
A.将两种样品分别溶于硝酸,区别所产生的气体
B.将两种样品分别溶于硝酸,区别溶液的颜色
C.取两种同质量的样品分别在高温灼烧,区别残留固体的质量
D.取两种同质量的样品分别在高温灼烧,区别残留固体的颜色
8、在含有Cu(NO3)2、Mg(NO3)2和AgNO3的溶液中加入适量锌粉,首先置换出的是
A.Mg B. Cu C. Ag D. H2
7、我国报道的高温超导体中,铊是组成成分之一。已知铊和铝是同族元素,关于铊的判断错误的是
A.铊是银白色的金属 B.氢氧化铊是两性氧化物
C.能生成+3价的化合物 D.能置换出盐酸中的氢离子
6、下列有关纯铁的描述正确的是
A.熔点比生铁的低 B.与相同浓度的盐酸反应生成氢气的速率比生铁的快
C.在潮湿空气中比生铁容易被腐蚀 D.在冷的浓硫酸中可钝化
5、某同学想用实验证明高锰酸钾溶液的紫红色是MnO4-离子的颜色,而不是K+的颜色,它涉及的下列实验步骤中没有意义的是
A.将高锰酸钾晶体加热分解,所得固体质量减少
B.观察氯化钾溶液没有颜色,表明溶液中K+无色
C.在氯化钾溶液中加入适量锌粉振荡,静置后未见明显变化,表明锌与K+无反应
D.在高锰酸钾溶液中加入适量锌粉振荡,静置后见紫红色褪去,表明MnO4-粒子为紫红色
4、铁屑溶于过量的稀硫酸,过滤后向滤液中加入适量硝酸,再加入过量的氨水,有红褐色沉淀生成。过滤,加热沉淀物至质量不再发生变化,得到红棕色的残渣。上述沉淀和残渣分别为
A.Fe(OH)3;Fe2O3 B.Fe(OH)2;FeO C.Fe(OH)2、Fe(OH)3;Fe3O4 D.Fe2O3;Fe(OH)3
3、将一定质量的Mg,Zn,Al混合物与足量稀H2SO4反应,生成H2 2.8L(标准状况),原混合物的质量可能是
A.2g B.4g C.8g D.10g
2、把a g铁铝合金粉末溶于足量盐酸中,加入过量NaOH溶液。过滤出沉淀,经洗涤、干燥、灼烧,得到红棕色粉末的质量仍为a g,则原合金中铁的质量分数为
A.70% B.52.4% C.47.6% D.30%
1、下列物质中,不属于合金的是
A.硬铝 B.黄铜 C.钢铁 D.水银
9.忽视铁单质与强氧化性物质反应时,也有生成二价铁化合物的可能性。反应中若铁为足量,最终铁元素将以二价铁形式存在,因为2Fe3++Fe=3Fe2+。
[典型例题评析]
例1 在下列各物质中,加入过量盐酸后,最终不产生沉淀或浑浊的是(1997年上海高考题)
A.偏铝酸钠溶液 B.苯酚钠溶液 C.硅酸钠溶液 D.硫代硫酸钠溶液
答案:A
例2 将等物质的量的镁和铝相混合,取等质量该混合物四份,分别加到足量的下列溶液中,充分反应后,放出氢气最多的是(1996年上海高考题)
A.3mol/LHCl B.4mol/LHNO3 C.8mol/LNaOH D.18mol/LH2SO4
答案:A
例3 下列物质能跟镁反应并生成氢气的是(1995年全国高考题)
A.甲酸溶液 B.氢氧化钠溶液 C.氯化铵溶液 D.碳酸钠溶液
答案:A、C
例4 甲、乙两烧杯中各盛有100mL3mol/L的盐酸和氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为甲:乙=1:2,则加入铝粉的质量为
A.5.4g B.3.6g C.2.7g D.1.6g
答案:A
例5 若在加入铝粉能放出氢气的溶液中,分别加入下列各组离子,可能共存的是(1995年上海高考题)
A.NH4+ NO3- CO32- Na+ B.Na+ Ba2+ Mg2+ HCO3-
C.NO3- Ca2+ K+ Cl- D.NO3- K+ AlO2- OH-
答案:C、D
了。
例6 将溶液(或气体)X,逐渐加入(或通入)到一定量的Y溶液中,产生沉淀的量与加入

 X物质的量的关系如图,符合图中情况的一组物质是(1991年上海高考题)
X物质的量的关系如图,符合图中情况的一组物质是(1991年上海高考题)
|
|
A |
B |
C |
D |
|
X |
H2S |
HCl |
NH3 |
NH3.H2O |
|
Y |
Na2SO3 |
NaAlO2 |
AlCl3 |
AgNO3 |
答案:B
例7 怎样将氯化铝和氯化铁的混合溶液分离成氯化铝和氯化铁两种溶液?(写出实验操作步骤和有关离子方程式)(1994年上海高考题)
答案:(1)向混合液中加过量NaOH溶液,过滤。Al3++4OH-=AlO2-+2H2O,Fe3++3OH-=Fe(OH)3↓
(2)把Fe(OH)3沉淀洗涤后加入盐酸到沉淀完全溶解得FeCl3溶液。Fe(OH)3+3H+=Fe3++3H2O
(3)取步骤(1)所得滤液,加入适量盐酸(或通入足量CO2)至完全沉淀为止。AlO2-+H++H2O=Al(OH)3↓(或AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-)
(4)再过滤,沉淀经洗涤后,再用盐酸溶解,得AlCl3溶液:Al(OH)3+3H+=Al3++3H2O
例8 四种化合物①NaHCO3,②Al(OH)3,③(NH4)2S,④Al中,跟盐酸和氢氧化钠溶液
都能反应的是(1991年全国高考题)
A.只有②④ B.只有①② C.只有①②③ D.①②③④
答案:D
例9 在一定条件下可实现下图所示物质之间的转化:(1995年全国高考题)
请填写以下空白:
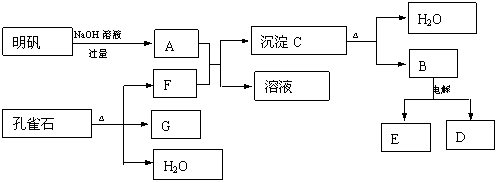
(1)孔雀石的主要成分是CuCO3.Cu(OH)2(碱式碳酸铜),受热易分解。下图中的F是_____。
(2)写出明矾溶液与过量NaOH溶液反应的离子方程式:______________________。
(3)图中所得G和D都为固体,混和后在高温下可发生反应,写出该反应的化学方程式:______________________。
(4)每生成1molD,同时生成____molE。
答案:(1)CO2(或二氧化碳(2)Al3++4OH-=AlO2-+2H2O(3)3CuO+2Al=====Al2O3+3Cu(4)3/4
例10 久置于空气中的下列物质,因被氧化而呈黄色的是(2000年全国高考题)
A.浓HNO3 B.氯化亚铁溶液 C.溴苯 D.溴化银
答案:B
例11 某溶液中有NH4+、Mg2+、Fe2+和Al3+4种离子,若向其中加入过量的NaOH溶液,微热并搅拌,再加入过量的盐酸,溶液中大量减少的阳离子是(1996年全国高考题)
A.NH4+ B.Mg2+ C.Fe2+ D.Al3+
答案:A、C
例12 将铁屑溶于过量盐酸后,再加入下列物质,会有三价铁生成的是(1998年全国高考题)
A.硫酸 B.氯水 C.硝酸锌 D.氯化铜
答案:B、C
例4 制印刷电路时常用氯化铁溶液作为“腐蚀液”:发生的反应为2FeCl3+Cu=2FeCl2+CuCl2向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是 A.烧杯中有铜无铁 B.烧杯中有铁无铜 C.烧杯中铁、铜都有 D.烧杯中铁、铜都无
答案:B
例13 在由Fe、FeO、和Fe2O3组成的混合物中加入100mL2mol/L的盐酸,恰好使混合物完全溶解,并放出448mL气体(标准状况),此时溶液中无Fe3+离子,则下列判断正确的是(1997年上海高考题)
A.混合物里3种物质反应时消耗盐盐酸的物质的量浓度之比为1:1:3
B.反应后所得溶液中的Fe2+离子与Cl-离子的物质的量浓度之比为1:2
C.混合物里,FeO的物质的量无法确定,但Fe比Fe2O3的物质的量多
D.混合物里,Fe2O3的物质的量无法确定,但Fe比FeO的物质的量多
答案:B、C
例14 Cu+在酸性溶液中不稳定,可发生自身氧化还原反应生成Cu2+和Cu。现有浓硫酸、浓硝酸、稀硫酸、稀硝酸、FeCl3稀溶液及pH试纸,简述如何用简便的实验方法来检验CuO经氢气还原所得红色产物中是否含有碱性氧化物Cu2O。(1992年全国高考题)
答案:取少量待检样品放入稀硫酸 ,振荡,若溶液变为蓝色,说明样品中有Cu2O,若溶液不变色,说明产物中无Cu2O。
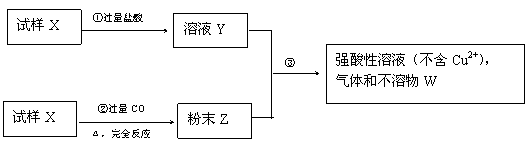 例15 试样X由氧化亚铁和氧化铜组成,取质量相等的两份试样按下图所示进行实验:
例15 试样X由氧化亚铁和氧化铜组成,取质量相等的两份试样按下图所示进行实验:
(1)请写出步骤③中所发生的全部反应的离子方程式。
(2)若全部的溶液Y和全部的粉末Z充分反应后,生成的不溶物W的质量是m,则每份试样X中氧化铜的质量为 。(用m表示)
答案:(1)Fe+Cu2+=Fe2++Cu Fe+2H+=Fe2++H2↑ (2)5m/8
例16 “卤块”的主要成分为MgCl2(含Fe2+、Fe3+、Mn2+等杂质离子),若以它为原料,按
如下工艺流程图,即可制得“轻质氧化镁”。(1997年高考试测题)

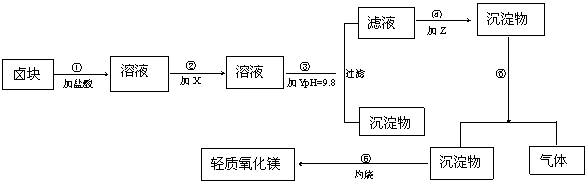
如果要求产品尽量不含杂质离子,而且成本较低。流程中所用试剂或pH控制可参考下列附表确定。
表1 生成氢氧化物沉淀的pH
|
物 质 |
开始沉淀 |
沉淀完全 |
|
Fe(OH)3 |
2.7 |
3.7 |
|
Fe(OH)2 |
7.6 |
9.6* |
|
Mn(OH)2 |
8.3 |
9.8 |
|
Mg(OH)2 |
9.6 |
11.1 |
*Fe2+氢氧化物呈絮状,不易从溶液中除去,所以常将它氧化成为Fe3+,生成沉淀Fe(OH)3而除去。
表2 工业品价格表
|
工业品 |
规 格 |
价格(元/t) |
|
漂 液 |
含NaClO 25.2% |
450 |
|
过氧化氢 |
30% |
2400 |
|
烧 碱 |
98% |
2100 |
|
纯 碱 |
99.5% |
600 |
|
卤 块 |
含MgCl2 30% |
310 |
请填写以下空白:
(1)在步骤②中加入的物质X,最佳选择应是 ,其作用是 。
(2)在步骤③中加入的物质Y应是 ,之所以要控制pH=9.8的目的是 。
(3)在步骤⑤时发生的化学反应方程式是: 。
答案:(1)漂液 使Fe2+氧化成为 Fe3+ (2)烧碱 使除Mg2+以外的各种杂质金属离子都生成氢氧化物沉淀以便过滤除去。 (3)MgCO3+H2O= Mg(OH)2↓+CO2↑
[巩固练习]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com