
题目列表(包括答案和解析)
8.某晶体水溶液中加入Fe2+的溶液,再加稀HNO3溶液立即变红,另取该晶体,加入NaOH溶液共热产生一种能使湿润红色石蕊试纸变蓝的气体,则这种晶体是
A.KSCN B. NH4SCN C. NH4Cl D. FeCl3
7.短周期元素中,A元素原子最外层电子数是次外层电子数的2倍;B元素最外层电子数是其内层电子总数3倍;C元素原子次外层电子数等于其原子核外电子总数的一半;D元素原子最外层有1个电子,D的阳离子与B的阴离子电子层结构相同,则4种元素原子序数关系中正确的是
A、 C>D>B>A B、 D>B>A>C C、 A>D>C>B D、 B>A>C>D
6.2004年4月15日重庆发生的氯气泄漏事故、2004年4月20日江苏扬州发生的氨气泄漏事故再一次给安全生产敲响了警钟。下列有关氯气和氨气的说法中正确的是
A.氯气和氨气都是易液化的气体
B.氯气和氨气都是无色、密度比空气大的有毒气体
C.氯气和氨气都是由极性键构成的分子
D.氯气和氨气分子中所有原子都满足最外层为8电子结构
5. 已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性强弱的顺序是SO2>I->H2O2>Fe2+>Cl-,则下列反应不可能发生的是
A.2Fe3++SO2+2H2O====2Fe2++SO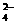 +4H+
+4H+
B.2Fe2++Cl2====2Fe3++2Cl-
C.I2+SO2+2H2O====H2SO4+2HI
D.H2O2+H2SO4====SO2+O2+2H2O
4.某溶液与Al反应能放出H2,下列离子在该溶液中一定能大量共存的是
A.NH4+、Fe2+、CO32-、SO42- B.Na+、K+、Cl-、SO42-
C.Mg2+、H+、Cl-、NO3- D.K+、Ca2+、HCO3-、Cl-
3.氢化钙可作生氢剂,反应方程式为CaH2+2H2O=Ca(OH)2+2H2↑,其中水的作用是
A.溶剂 B.还原剂 C.氧化剂 D.既作还原剂又氧化剂
2.目前,科学家拟合成一种“二重构造”的球形分子,即把足球型的C60分子熔进Si60的分子中,外面的硅原子与里面的碳原子以共价键结合。下列说法正确的是
A、它是由两种单质组成的混合物 B、它是一种硅酸盐
C、它是一种新型化合物 D、它是一种合金
1. 氢元素与其他元素形成的二元化合物称为氢化物,下面关于氢化物的叙述正确的是
A.一个D2O分子所含的中子数为8 B.NH3的结构式为
C.HCl的电子式为 D.热稳定性:H2S>HF
D.热稳定性:H2S>HF
21、硫酸亚铁(FeSO4·7H2O)是一种重要的食品和饲料添加剂。实验室通过如下实验由废铁屑制备FeSO4·7H2O晶体:
①将5% Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去Na2CO3溶液,然后将废铁屑用水洗涤2 ~ 3遍;
②向洗涤过的废铁屑中加入过量的稀硫酸,控制温度在50 ~ 80℃之间至铁屑耗尽;
③趁热过滤,将滤液转入到密闭容器中,静置、冷却结晶;
④待结晶完毕后,滤出晶体,用少量冰水洗涤2 ~ 3次,再用滤纸将晶体吸干;
⑤将制得的FeSO4·7H2O晶体放在一个小广口瓶中,密闭保存。
请回答下列问题:
(1)实验步骤①的目的是 ,加热的作用是 。
(2)实验步骤②明显不合理,理由是 。
(3)实验步骤④中用少量冰水洗涤晶体,其目的是 ;
。
(4)经查阅资料后发现,硫酸亚铁在不同温度下结晶可分别得到FeSO4·7H2O、FeSO4·4H2O和FeSO4·H2O。硫酸亚铁在不同温度下的溶解度和该温度下析出晶体的组成如下表所示(仅在56.7℃、64℃温度下可同时析出两种晶体)。
|
温度/℃ |
0 |
10 |
30 |
50 |
56.7 |
60 |
64 |
70 |
80 |
90 |
||
|
溶解度/g |
14.0 |
17.0 |
25.0 |
33.0 |
35.2 |
35.3 |
35.6 |
33.0 |
30.5 |
27.0 |
||
|
析出晶体 |
FeSO4·7H2O |
FeSO4·4H2O |
FeSO4·H2O |
|||||||||
若需从硫酸亚铁溶液中结晶出FeSO4·4H2O,应控制的结晶温度(t)的范围为 。
20、锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成Zn(NH3)42+。回答下列问题:
(1)单质铝溶于氢氧化钠溶液后,溶液中铝元素的存在形式为 (用化学式表示)。
(2)写出锌和氢氧化钠溶液反应的化学方程式 。
(3)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是 。
① 硫酸铝和氢氧化钠 ② 硫酸铝和氨水 ③ 硫酸锌和氢氧化钠 ④ 硫酸锌和氨水
(4)写出可溶性铝盐与氨水反应的离子方程式 。
试解释在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌的原因 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com