
题目列表(包括答案和解析)
5.下列反应的离子方程式错误的是( )
A.小苏打与盐酸反应HCO3-+H+ CO2↑+H2O
CO2↑+H2O
B.碳酸氢钙与足量氢氧化钠溶液反应
Ca2++2HCO3-+OH- CaCO3↓+H2O+HCO3-
CaCO3↓+H2O+HCO3-
C.钾与水反应K+2H2O K++2OH-+H2↑
K++2OH-+H2↑
D.氢氧化钠与三氯化铁溶液反应
Fe3++3OH- Fe(OH)3↓
Fe(OH)3↓
4.在3Cl2+6NaOH NaClO3+5NaCl+3H2O的反应中,下列说法正确的是.( )
NaClO3+5NaCl+3H2O的反应中,下列说法正确的是.( )
A.NaCl是氧化产物,NaClO3是还原产物
B.被氧化的氯原子与被还原的氯原子物质的量之比为1∶5
C.Cl2既是氯化剂又是还原剂
D.氧化剂得电子数与还原剂失电子数之比为1∶5
3.下列实验操作正确的是( )
A.使用容量瓶配制溶液,移液时应洗涤烧杯2-3次.
B.用100ml量筒量取2.50ml稀盐酸
C.用托盘天平称量25.20gNaCl固体
D.使用滴定管前,只用水润洗滴定管
2.下列反应中,水只作还原剂的是( )
A.CaO+H2O=Ca(OH)2
B.C+H2O CO+H2
CO+H2
C.2F2+2H2O=4HF+O2↑ D.3NO2+H2O=2HNO3+NO
1.下列物质属于电解质的是( )
①NaOH ②蔗糖 ③Na2CO3 ④Cu ⑤酒精
A.①②③ B.①③ C.②④ D.④
23.(8分)实验室需配制4.6 mol·L-1的H2SO4溶液100mL。
⑴ 需要浓度为18.4 mol·L-1的浓硫酸 mL。
⑵ 需要用的玻璃仪器除烧杯、量筒外还有 。
⑶ 向50 mL浓度为18.4 mol·L-1的浓硫酸中加入过量的锌使H2SO4全部反应,生成标准状况下的气体16.8L。
计算:
① 反应中消耗的锌的质量;
②反应中生成的氢气在标准状况下的体积
22.(6分)单质溴微溶于水形成棕红色溴水。向溴水中通入SO2气体,溴水变成无色溶液,将该无色溶液分成两份,向其中一份中滴加AgNO3溶液生成淡黄色的AgBr沉淀。向另一份无色溶液中滴加双氧水(H2O2),溶液变成红棕色。回答下列问题:
⑴ 写出溴水中通入SO2气体时反应的离子方程式 。
⑵ 将无色溶液中滴加双氧水时反应的离子方程式补充完整:
▲ H2O2+ ▲ Br-+ ▲ ▲ = ▲ Br2+ ▲ ▲
⑶ 由上述反应可知,Br2的氧化性 (填“大于”或“小于”,下同)H2O2,SO2的还原性 Br-。
21.(8分)下图是中学化学中常见的一些单质或化合物之间的转化关系图,其中部分反应中涉及到的水未列出。已知A是厨房中最常见的调味品,B、F是人类生存必不可少的物质,E、H均为淡黄色固体粉末,且H单质存在于火山喷口附近,I、J均具有漂白性,但两者混合后的产物均不具有漂白性。

请回答下列问题:
⑴ A中的金属元素在元素周期表中的位置为 。
⑵ H的化学式为 。
⑶ 已知J的水溶液显较强的碱性,且反应③中有水生成。写出下列反应的离子方程式:
反应① ,反应② ,反应③ 。
20.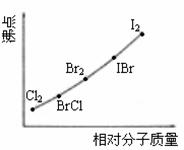 (6分)卤素互化物是指不同卤素原子之间以共价键结合形成的化合物,XX’型卤素互化物与卤素单质结构相似、性质相近。
(6分)卤素互化物是指不同卤素原子之间以共价键结合形成的化合物,XX’型卤素互化物与卤素单质结构相似、性质相近。
已知:卤素互化物BrCl能发生下列反应
H2O+BrCl===HBrO+HCl
KBr+BrCl===KCl+Br2
试回答下列问题:
(1)写出KI与IBr反应的化学方程式______________。
(2)右图是部分卤素单质和XX’型卤素互化物的沸点与其相对分子质量的关系图。它们的沸点随着相对分子质量的增大而升高,其原因是______________ 。
(3)试推测ICl的沸点所处的最小范围______________ 。
19.(8分)工业上硫酸亚铁是生产颜料氧化铁红的原料,其化学方程式为:
2FeSO4 高温==== Fe2O3+SO2↑+SO3↑。为了检验FeSO4高温分解的产物,某研究性学习小组进行了如下实验操作:
⑴ 取少量FeSO4高温分解得到的固体残渣,加一定量稀硝酸溶解,向该溶液中加入适量的KSCN,观察溶液颜色的变化。
甲同学认为根据溶液颜色变成_________色,可以证明FeSO4高温分解的产物中有Fe2O3。你认为甲同学的判断正确吗?_____ (填“正确”或“不正确”),理由是_____
_____________________________________________________________________。
⑵乙同学先用下图所示装置检验该反应所产生的气态物质,然后用装置中A瓶内的混合物来测定已分解的FeSO4的质量。

已知:SO2的沸点为-10℃,请回答相关问题:
①A瓶所盛试剂的作用是__________________________________;B瓶所盛的试剂是___________;C瓶所盛试剂的作用是________________________________________。
②A瓶要用冷水冷却的原因是________________________________________。
③将此反应生成的气体通入A瓶BaCl2溶液中,则_________。(填编号)
A.析出BaSO3沉淀 B.析出BaSO4沉淀
C.逸出SO3气体 D.逸出SO2气体
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com