
题目列表(包括答案和解析)
7.下列递变情况中,正确的是
A.Na、Mg、Al原子的最外层电子数依次减少
B.Si、P、S元素的最高正价依次降低
C.C、N、O的原子半径依次减小 D.Li、Na、K的金属性依次减弱
6. 下列表达方式错误的是
下列表达方式错误的是
A.H∶Cl B.
C.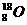 D.O=C=O
D.O=C=O
5. 元素性质呈现周期性变化的根本原因是
A.元素的相对原子质量递增,量变引起质变
B.元素原子的核外电子排布呈周期性变化
C.元素的原子半径呈周期性变化
D.元素的化合价呈周期性变化
4. 下列物质中,只含有离子键,不含有共价键的是
A.HCl B.KOH C.CaCl2 D.CO2
3. 某元素原子的原子核外有三个电子层,最外层电子数是4,该原子核内的质子数是
A.14 B.15 C.16 D.17
2. 下列各组粒子中属于同位素的是
A.16O和18O B.H2O和D2O C.H2和D2 D.24Mg和24Na
1.
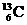 -NMR(核磁共振)可用于含碳化合物的结构分析,
-NMR(核磁共振)可用于含碳化合物的结构分析,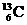 表示的是
表示的是
A.核外有13个电子,其中6个能参与成键
B.核内有6个质子,核外有7个电子
C.质量数是13,原子序数是6,核内有7个质子
D.质量数是13,原子序数是6,核内有7个中子
相对原子质量:H 1 C 12 N 14 O 16 F 19 S 32 Cl 35.5 Ca 40
32.已知元素的电负性与元素的化合价一样,也是元素的一种基本性质。下面给出14种元素的电负性。
|
元 素 |
Al |
B |
Be |
C |
Cl |
F |
Li |
Mg |
N |
Na |
O |
P |
S |
Si |
|
电负 性 |
1.5 |
2. |
1.5 |
2.5 |
2.8 |
4. |
1.0 |
1.2 |
3.0 |
0.9 |
3.5 |
2.1 |
2.5 |
1.7 |
根据以上的数据,可推知元素的电负性具有的变化规律是: 。
31.下表是元素周期表的一部分, 针对表中的①-⑨种元素,填写下列空白:
|
主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0族 |
|
2 |
|
|
|
① |
② |
③ |
|
|
|
3 |
④ |
|
⑤ |
|
|
⑥ |
⑦ |
⑧ |
|
4 |
⑨ |
|
|
|
|
|
|
|
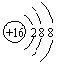
(1) 在这些元素中,化学性质最不活泼的是: (填具体元素符号,下同)。原子结构示意图为_____________________ 。
(2) 在最高价氧化物的水化物中,酸性最强的化合物的分子式是_______,碱性最强的化合物的电子式是:_____________。
(3) 最高价氧化是两性氧化物的元素是_____ ____;写出它的氧化物与氢氧化钠反应的离子方程式_____ _________ _________ _________ _________ ____。
(4) 用电子式表示元素④与⑥的化合物的形成过程: ,该化合物属于 (填 “共价”或“离子”)化合物。
(5)表示①与⑦的化合物的电子式 ,该化合物是由 (填“极性”“非极性”下同)键形成的。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com