
题目列表(包括答案和解析)
16. 右图是某校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容,据此下列说法正确的是
右图是某校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容,据此下列说法正确的是
A.常温下该硫酸不能用铁制容器盛装
B.1molZn与足量的该硫酸反应产生2gH2
C.配置250mL 4.6mol/L的稀硫酸需取该硫酸62.5mL
D.配制浓度为9.2mol/L的硫酸时,向100mL该硫酸中滴加蒸馏水直到溶液体积为200mL
请将选择题答案填在下列表格中:
15.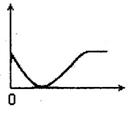 下列实验过程中产生的现象与右边座标图形相符合的是
下列实验过程中产生的现象与右边座标图形相符合的是
A.稀盐酸滴加到一定量NaHCO3,溶液中(横坐标是稀盐酸的体积,纵坐标为气体体积)
B.NaOH溶液滴入Ba(HCO3)2溶液中(横坐标是NaOH溶液的体积,纵坐标为沉淀质量)
C.稀盐酸滴加到AgNO3溶液中(横坐标是稀盐酸的体积,纵坐标为溶液的导电能力)
D.稀硫酸滴加到Ba(OH)2溶液中(横坐标是稀硫酸的体积,纵坐标为溶液的导电能力)
14.从海水中提取镁,可按如下步骤进行:
①把贝壳制成石灰乳;②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物;③将沉淀物与盐酸反应,结晶,过滤、得到含结晶水的晶体;④将得到晶体在一定条件下加热得到无水氯化镁;⑤电解无水氯化镁,得到金属镁。下列说法中错误的是
A.此法的优点之一是原料来源丰富
B.①②③步骤的目的是从海水中提取MgCl2
C.以上提取镁的过程中涉及化合、分解和复分解反应
D.以上提取镁的过程中涉及的反应均不是氧化还原反应
13.在生活、生产及化学研究中,人们经常需要根据不同原子、分子或离子的某些特征反应对物质进行区别、检验等。下列说法正确的是
A.用KOH溶液可以将NH4Cl、NaBr、CuSO4、FeCl3区别开
B.C、CuO、Fe三种物质的粉末都是黑色的,用稀盐酸不能将它们区别开
C.某溶液中加入稀盐酸有无色气体产生,该气体能使澄清石灰水变浑浊,则此溶液中一定含有CO32¯
D.可以用BaCl2溶液和稀硝酸检验Na2SO3是否变质
12.进行化学实验,观测实验现象,通过分析推理得出正确的结论是化学学习的方法之一。下列对有关实验事实的解释正确的是
A.SO2气体使溴水褪色,表现了SO2的漂白性
B.浓硝酸在光照条件下变黄,说明浓硝酸易分解生成有色产物且溶于浓硝酸
C.常温下,将铝片放入浓硫酸中,无明显现象,说明铝不与冷的浓硫酸反应
D.向CuSO4溶液中加入一小块金属钠,则钠与Cu2+反应可置换出铜
11.纯碱和小苏打都是白色晶体,在日常生活中都可以找到。如要在家中将它们区分开来,下面的方法中可行的是
A.分别放在炒锅中加热,观察是否有残留物
B.分别用干净铁丝蘸取样品在煤气炉的火焰上灼烧,观察火焰颜色
C.将样品溶解,分别加入澄清石灰水,观察是否有白色沉淀
D.在水杯中各盛相同质量的样品,分别加入等体积的白醋,观察反应的剧烈程度
10.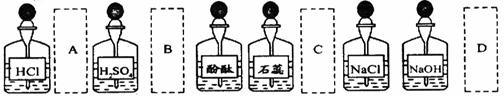 实验室中的药品常按物质的性质、类别等有规律地摆放。现有部分药品按某种规律的摆放在实验桌上,如下图。做“硫酸的性质”的实验时,某同学取用BaCl2溶液后,应把它放回的位置是
实验室中的药品常按物质的性质、类别等有规律地摆放。现有部分药品按某种规律的摆放在实验桌上,如下图。做“硫酸的性质”的实验时,某同学取用BaCl2溶液后,应把它放回的位置是
9.下列离子方程式的书写正确的是
A.铁和稀硝酸反应:Fe + 2H+ = H 2↑+ Fe 2+
B.NaHCO3溶液与NaOH溶液反应: OH- + HCO3- = CO32- + H2O
C.氯气溶于水 Cl2+H2O 2H++Cl-+ClO-
2H++Cl-+ClO-
D.氯化铝溶液中加入过量的氨水 Al3+ + 4NH3·H2O =AlO2- + 4NH4++ 2H2O
8.在强酸性的溶液中能大量共存的离子组是
A.Na+、 Fe2+、Cl-、NO3- B.Na+、 K+、AlO2-、NO3-
C.NH4+、 Mg2+、SO42-、Cl- D. Al3+、 Fe3+、SO42-、I-
7.下列说法正确的是(NA为阿伏加德罗常数)
A.1.8gNH4+含有的电子数为0.1NA
B.2.3g金属钠反应生成Na2O2时失去的电子数为0.2NA
C.标准状况下,11.2L的CCl4所含的分子数为0.5NA
D.24 g O2分子和24 g O3分子所含的氧原子数目相等
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com