
题目列表(包括答案和解析)
24、(1) 溶解金(Au)、铂(Pt)应该用 (填名称);
(2) 漂白粉的有效成分是 (填化学式);
(3) 酸雨的pH 5.6 (选填“>”、“<”或“=”);
(4) 少量钠保存在 中(选填“煤油”、“四氯化碳”或“水”);
(5) 鉴别硅酸胶体和食盐溶液的方法是 (选填“过滤”、“丁达尔现象”或“加热蒸干”)。
23、有一可能已变质的Na2SO3样品(无水)。某化学兴趣小组展开了对该样品分析,请你参与他们的活动。
(1)猜想样品中可能含Na2CO3、 和 (填化学式)。
(2)实验设计
①取适量样品于烧瓶中配成无色溶液,先加入过量的BaCl2溶液;
②待沉淀完全后,从分液漏斗向烧瓶中放出下列溶液 ,产生气体。
A.稀H2SO4 B. 稀HNO3 C. 稀HCl
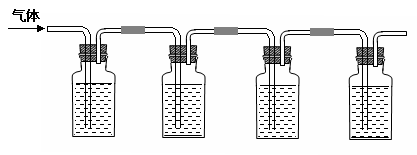 ③将气体连续通入下列装置:
③将气体连续通入下列装置:
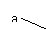
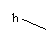
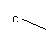
注:上述装置中a、b、c、d分别是品红溶液、酸性高锰酸钾溶液、品红溶液、石灰水。
(3)结论:样品已部分变质。
(4)问题讨论:
i.某同学认为实验步骤①多余,你认为该步骤 (选填“是”或“不是”)多余,(若选“不是”继续回答下一空格,若选“是”不必回答下一空格),设计的用意是 。
ii. 实验步骤③中a、b、c、d的作用分别是
a b ,
c d 。
22、利用下图所示装置制备氧气并进行相关实验探究。
(1)将3.9g过氧化钠放入烧瓶中,加入100mLH2O,用排水法收集气体,过氧化钠与水反应的化学方程式是
。
(2)已知:酚酞在c(OH-) 为1.0×10-4mol/L-2.5mol/L时呈红色,且半分钟内不褪色;H2O2具有氧化性和漂白性,MnO2催化条件下迅速分解。取上述实验得到的溶液于试管中,滴入2滴酚酞试液,溶液变红色,片刻红色褪去。(假设过程中液体体积不变)
①甲同学认为“红色迅速褪去”是由于溶液中c(OH-)过大造成的。请通过计算对比数据加以说明上述观点是否正确。 。
②乙同学认为“红色迅速褪去”是由于溶液中存在H2O2,其来源可能是Na2O2+2H2O=2NaOH+H2O2。试设计简单实验证明烧瓶内溶液中含H2O2,简述实验原理 。
20、mg铜与一定体积18.5mol/L的硫酸加热反应,得到标准状况下SO2 nL, 下列数据表示反应中硫酸作为氧化剂的物质的量(单位为mol),其数据一定正确的是
A. n/22.4 B. m/64 C.m/32 D.98n/22.4
第II卷(非选择题 共50分)
19、两种金属混合物6.0g,与氯气完全反应,消耗氯气7.1g,则合金的组成可能是
A. Cu和Zn B. Na和Zn C. Fe和Ca D. Cu和Ca
18、某干燥的无色混合气体中可能含有Cl2、O2、NH3、NO、NO2、SO2、N2中一种或几种,通过浓硫酸,气体体积减少,后通过碱石灰,气体体积减少,再与空气接触,气体变为红棕色。则下列判断正确的是
A.一定有NH3、NO、SO2 B. 一定没有Cl2、O2、NO2
C.可能有N2 D.以上说法都正确
17、下列有关实验操作或判断正确的是
A. 苯、CCl4、酒精可用来萃取溴水中的溴
B. 制备Fe(OH)2时将取有NaOH溶液的长滴管伸入盛有FeSO4溶液的试管中
C. 配制一定物质的量浓度溶液,定容时俯视刻度线会导致所配溶液浓度偏大
D. 在某盐溶液中加浓NaOH溶液,用玻璃棒蘸取溶液滴在湿润红色石蕊试纸上,试纸变红色证明溶液中含NH4+
16、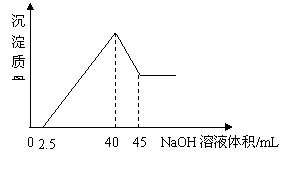 取一定量的铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有100 mL H2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10 mol/L的NaOH溶液, 产生沉淀的量与所加NaOH溶液的体积的关系如右图所示。则原H2SO4物质的量浓度是
取一定量的铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有100 mL H2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10 mol/L的NaOH溶液, 产生沉淀的量与所加NaOH溶液的体积的关系如右图所示。则原H2SO4物质的量浓度是
A.1mol/L B.2mol/L
C.3mol/L D.4mol/L
15、在pH=1的溶液中,下列各组离子能够大量共存的是
A.Cl-、Fe3+、CO32-、Ca2+ B.NH4+、NO3-、Cl-、K+
C.K+、Ba2+、Cl-、SO42- D.Fe2+、NO3-、Na+、Cl-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com