
题目列表(包括答案和解析)
3、下列各组物质中,反应后生成碱和氧气的是
A、Na和H2O B、Na2O和H2O C、Na2O2和H2O D、K和H2O
2、农药波尔多液不能用铁制容器盛放,是因铁能与该农药中的硫酸铜起反应。在该反应中,铁
A、是氧化剂 B、是还原剂 C、是催化剂 D、是漂白剂
1、下列物质属于非电解质的是
A.H2SO4 B.NH3 C.N2 D.NaCl
23.(7分)使一定质量的锌与100mL18.5mol/L浓硫酸充分反应。
⑴若锌完全溶解,同时生成标准状况下SO2气体3. 36L,假设反应前后溶液体积保持不变,求所得溶液中硫酸锌的物质的量浓度。
(化学反应方程式为:Zn + 2H2SO4(浓)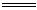 ZnSO4
+ SO2↑+ H2O)。
ZnSO4
+ SO2↑+ H2O)。
⑵若锌完全溶解,同时生成标准状况下SO2和H2的混合气体为33.6L,并将反应后的溶液稀释至1L,测得溶液中c(H+)为0.100mol/L,求混合气体中各组分的体积比。
22.(6分)使9.6g Cu与足量浓硝酸反应,生成NO2气体物质的量是多少?若用排水法收集可收集到标况下气体多少升?
21.(10分) A-I分别表示中学化学中的常见物质,它们之间的相互转化关系如下图所示(部分反应物、生成物没有列出),且已知G是一种两性氧化物,A、B、C、D、E、F六种物质中均含有同一种元素,F为红褐色沉淀。
请填写下列空白:
(1) A、B、C、D、E、F六种物质中所含的同一种元素是 (写元素符号)。
(2) 写出物质C、G的化学式:C ,G 。
(3) 写出反应①、⑥的化学方程式:
反应①: 。
反应⑥: 。
20.(10分)工业上硫酸亚铁是生产颜料氧化铁红的原料,其化学方程式为:
2FeSO4高温====Fe2O3+SO2↑+SO3↑。为了检验FeSO4高温分解的产物,某研究性学习小组进行了如下实验操作:
⑴取少量FeSO4高温分解得到的固体残渣,加一定量稀硝酸溶解,向该溶液中加入适量的KSCN,观察溶液颜色的变化。
甲同学认为根据溶液颜色变成_________色,可以证明FeSO4高温分解的产物中有Fe2O3。你认为甲同学的判断正确吗?_____(填“正确”或“不正确”),理由是_____
_____________________________________________________________________。
⑵乙同学先用下图所示装置检验该反应所产生的气态物质,然后用装置中A瓶内的混合物来测定已分解的FeSO4的质量。
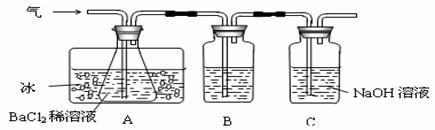
已知:SO2的沸点为-10℃,请回答相关问题:
①A瓶所盛试剂的作用是__________________________________;B瓶所盛的试剂是___________;C瓶所盛试剂的作用是________________________________________。
②A瓶要用冷水冷却的原因是________________________________________。
③将此反应生成的气体通入A瓶BaCl2溶液中,则_________。(填编号)
A.析出BaSO3沉淀 B.析出BaSO4沉淀
C.逸出SO3气体 D.逸出SO2气体
理由是__________________________________________________________________。
19.(3分)下列有关实验操作或判断不正确的是 _____________(填序号,多选扣分)。
A.配制一定物质的量浓度溶液,定容时俯视刻度线会导致所配溶液浓度偏大
B.少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗
C.配制稀硫酸时,可先在烧杯中加入一定体积的蒸馏水,再边缓慢加入浓硫酸边搅拌
D.100 mL容量瓶可用于配制95 mL 0.1 mol/L NaCl溶液
E.在天平左右两盘中各放一张白纸后,即可将NaOH固体放在白纸上称量
F.观察钾元素焰色反应的操作是:先将铂丝放在稀盐酸中洗涤,然后蘸取固体氯化钾,置于酒精灯的火焰上进行灼烧,透过蓝色钴玻璃进行观察。
G.苯、CCl4、酒精可用来萃取溴水中的溴。
18.(8分)写出下列反应的化学方程式或离子方程式。
(1)漂白粉溶液中通入过量的二氧化碳的化学方程式 ___________________________
(2)足量的氯气通入到溴化亚铁溶液中的离子方程式_________________________________
(3)硫酸工业生产中在沸腾炉中发生的反应的化学方程式_____________________________
(4)二氧化硫使溴水褪色的化学方程式__________________________________
17.(8分)我国政府为了消除碘缺乏病,规定在食盐中必须加人适量的碘酸钾。检验食盐中是否加碘,可利用如下反应: KIO3+ KI+ H2SO4=== K2SO4+ I2+ H2O
(1) 将上面氧化还原反应的化学方程式配平
(2)该反应中氧化剂和还原剂的物质的量之比为 。
(3)如果反应中转移0.2mol电子,则生成I2的物质的量为_________________。
(4)利用上述反应检验食盐中是否加碘,所需试剂是________________(填下列选项的序号)
①碘水 ②KI溶液 ③淀粉溶液 ④稀硫酸 ⑤AgNO3溶液
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com