
题目列表(包括答案和解析)
34.(5分)
(1)杀死水中的病菌(1分)
(2)明矾[或KAl(SO4)2·12H2O] (1分)
(3)漏斗 、 烧杯 、 玻璃棒 (各1分)
|
(1)Cu + 2H2SO4 ==== CuSO4 + SO2↑ + 2H2O(2分)
(2)反应过程中H2SO4被不断消耗,且生成的水逐渐增多,使浓硫酸浓度变稀,至一定浓度时就不再与铜片反应。(2分)
(3)AD(2分)
33.(6分)
(1)AgCl (2)Na2CO3 HCl AgNO3 BaCl2 NaHSO4 (各1分)
|
(1)2NaCl + 2H2O ==== 2NaOH + H2↑+ Cl2↑(2分)
(2)①SiO2(1分) 还原剂 (1分)
|
③SiCl4 + 2H2 ==== Si + 4HCl(2分)
32.(9分)
(1)2Al + 2NaOH + 2H2O == 2NaAlO2 + 3H2↑(2分)
(2)Al(OH)3+3H+ = Al3++3H2O(2分)
H+ + HCO3- = CO2↑ + H2O(2分)
(3)氨水(1分)
Al3+ + 3NH3·H2O = Al(OH)3↓+3NH4+(2分)
36. (7分)将镁铝的固体混合物0.1mol溶于100mL 2mol·L-1稀硫酸中充分反应后,固体全部溶解,然后再向反应后的混合溶液中滴加1mol·L-1NaOH溶液。
(1)若在滴加NaOH溶液过程中,使Mg2+、Al3+全部生成沉淀,则滴入的NaOH溶液体积是 mL。
(3)设0.1mol镁铝固体混合物中Mg的物质的量分数为a,若在滴加NaOH溶液450mL后,所得沉淀只有Mg(OH)2,则a的取值范围是 。
高一化学期末考试试题答案及评分标准
35.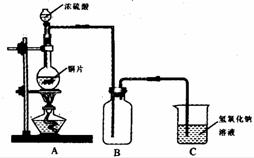 (6分)某研究性小组为探究铜跟浓
(6分)某研究性小组为探究铜跟浓
硫酸的反应情况,设计了如图所示装置进行有关实验:实验中他们取6.4g铜片与12mL 18mol/L浓硫酸放在圆底烧瓶中加热,直到反应完毕,最后发现烧瓶中有铜剩余。
(1)写出铜跟浓硫酸反应的化学方程式:
。
(2)该小组认为还应有一定量的硫酸剩余。请说明铜片未完全溶解并仍有一定量余酸的原因: 。
(3)为证明反应结束后的烧瓶中确有余酸,可选用下列药品中的 (填写字母编号)。
A.铁粉 B.BaCl2溶液 C.银粉 D.Na2CO3溶液
34.(5分)当我们轻轻拧开水龙头的时候,洁净的自来水“哗哗”流出时;你可曾想过自来水是怎样来的?下图是中山市自来水公司生产工艺流程图:

请回答下列问题:
(1)抽水泵站将源水抽起,加氯系统加氯,目的是 ;
 (2)常用
作净水剂;
(2)常用
作净水剂;
(3)右图为过滤池,在实验室要完成过滤,需要的玻璃仪器有 、 、 。
33.(6分) A、B、C、D、E 五瓶透明溶液,分别是HCl、BaCl2、NaHSO4、Na2CO3、AgNO3中的一种。
①A与B反应有气体生成 ②B与C反应有沉淀生成
③C与D反应有沉淀生成 ④D与E反应有沉淀生成
⑤A与E反应有气体生成 ⑥在②和③的反应中生成的沉淀是同一种物质
请填空:
(1)在②和③的反应中,生成的沉淀物质的化学式(分子式)是 。
(2) A是 ,B是 ,C是 ,
D是 ,E是 。
32.(9分)
铝是应用最广泛的金属之一,铝的化合物在生产和生活中也有许多用途。
(1)铝制容器不能盛装NaOH溶液,主要原因是什么?(用化学方程式表示)
;
(2)胃舒平是治疗胃酸(HCl)过多的常用药物,其中含有的有效成分是氢氧化铝,其治疗原理是(用离子方程式表示):
;
碳酸氢钠也常用于治疗胃酸过多,写出反应的离子方程式:
;
(3)为完全沉淀硫酸铝溶液中的铝元素。常加入过量的 ,
反应的离子方程式: 。
31.(7分)
(1)电解饱和食盐水可以制得烧碱、氯气和氢气,该反应的化学方程式为:
。
(2)氯气用于生产半导体材料硅的流程如下:
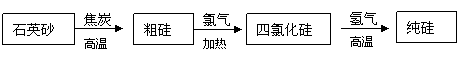
①石英砂的主要成分是 ,在制备粗硅时,焦炭的作用是 。
②粗硅与氯气反应后得到的液态四氯化硅中常混有一些杂质,必须进行分离提纯。其提纯方法为 。
③由四氯化硅得到高纯硅的化学方程式是:
。
30. 将过量铁粉放入100mL 2mol/L的HNO3溶液中,假设还原产物只有NO且HNO3完全反应,则参加反应Fe的质量为( )
A. 2.8g B. 5.6g C. 4.2g D. 11.2g
第II卷(共40分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com