
题目列表(包括答案和解析)
6.下列有关氧化还原反应的叙述正确的是
A.肯定有一种元素被氧化,另一种元素被还原 B.在反应中一定所有元素的化合价都发生变化 C.置换反应一定属于氧化还原反应 D.化合反应和分解反应中不可能有氧化还原反应
5.用NA表示阿伏加德罗常数的值,下列说法中正确的是
A.标准状况下,2.24L水含有NA个水分子
B.氧气和臭氧的混合物3.2 g中含有NA个氧原子
C.7.8 g Na2O2与水反应时转移0.1NA个电子
D.1.12 L氯气中含有NA个氯原子
4.下列物质属于纯净物的是
A.漂白粉 B.氯水 C.液氯 D.盐酸
3.下列关于摩尔的叙述中正确的是
A.摩尔是物质质量的单位
B.摩尔是物质数量的单位
C.摩尔既表示物质微粒数量,又表示物质质量,是具有双重意义的单位
D.摩尔是物质的量的单位,每摩尔物质含有阿伏加德罗常数个微粒
2.在我们的日常生活中出现了“加碘食盐”、“增铁酱油”、“高钙牛奶”、“富硒茶叶”、“含氟牙膏”等商品。这里的碘、铁、钙、硒、氟,应理解为
A.单质 B.分子 C.元素 D.氧化物
1.2007年12月中央召开的经济工作会议上提出我国当前国民经济建设中要大力抓好节能降耗、保护环境。下列举措中违背了这一指导思想的是
A.加大开发太阳能、水能、风能、地热能等能源力度,减少化石燃料的使用
B.研制乙醇汽油(汽油中添加一定比例的乙醇)技术,降低机动车辆尾气中有害气体排放
C.生产和生活中,努力实现资源的循环利用
D.利用高新技术,提高石油、煤、天然气产量,以满足工业生产快速发展的需求
20.(16分)请分析回答某同学在探究浓硫酸、稀硫酸、浓硝酸、稀硝酸分别与铜反应的实
验中发生的有关问题。
Ⅰ.探究上述四种酸氧化相对强弱及其与铜反应的还原产物的性质
(1)分别向盛有等量铜片的四支试管中加入等体积的①浓硫酸 ②稀硫酸 ③浓硝酸
④稀硝酸,能随即发生反应的是(填序号,下同) ,微热则发生反应的是 ,加热后发生反应的是 ,加热也不发生反应的是
。由此可以得到上述四种酸氧化性由强到弱的顺序是:
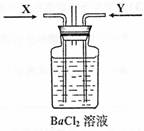 (2)先将铜与浓硫酸反应产生的气体X持续通入右下图装置中,一段时间后再将铜与浓硝酸反应产生的大量气体Y也持续通入该装置中,可观察到的现象包括(可选多项,但多选倒扣分,下同)
(2)先将铜与浓硫酸反应产生的气体X持续通入右下图装置中,一段时间后再将铜与浓硝酸反应产生的大量气体Y也持续通入该装置中,可观察到的现象包括(可选多项,但多选倒扣分,下同)
A.通入X气体后产生白色沉淀
B.通入X气体后溶液中无明显现象
C.通入Y气体后开始沉淀
D.通入Y气体后沉淀溶解
E.通入Y气体后溶液中无明显现象
由此可得到的结论是
A.HNO3的酸性比H2SO4强
B.盐酸的酸性比H2SO3强
C.BaSO3能溶于盐酸
D.HNO3能氧化H2SO3(或SO2)
E.BaSO4不溶于水也不溶于HNO3溶液
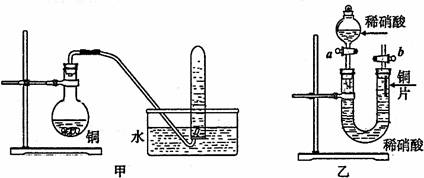 Ⅱ.下图是甲、乙两位同学探究铜与稀硝酸反应还原产物的实验装置图,请回答下列问题:
Ⅱ.下图是甲、乙两位同学探究铜与稀硝酸反应还原产物的实验装置图,请回答下列问题:
(1)写出铜和稀硝酸反应的离子方程式 。
(2)实验装置甲能否证明铜和稀硝酸反应的产物是NO气体 (填:“能”或“不能”),请简述理由(包括化学方程式)是
(3)若用实验装置乙进行实验,检查装置气密性的操作是
20(共16分)
I.(1)每空1分,共5分。 ③、④、①、②;③>④>①>②
(2)每项1分,共2分(每错答l项倒扣1分)。 B C
(3)答出4项得2分,答出3项得1分,答出1项和2项的不得分(每错答1项倒扣1分)。
B C D E
Ⅱ(1)3Cu+8H++2NO3-=3Cu+2NO +4H2O(2分)
+4H2O(2分)
(2)不能(1分),因为烧瓶内有氧气,能氧化NO气体生成红棕色的NO2(1分), 2NO+O2=2NO2(1分)。
(3)关闭活塞b打开活塞a,通过分液漏斗向U型管内加水,若加入少最水后漏斗中的水不再下滴并能保持此状态一段时问,则说明该装置的气密性良好(2分)。
19.(共6分,每空(项)1分)
①不能 ②第二步加入的碳酸钠溶液为过量的,最后所得晶体中应有碳酸钠存在
|
丙 |
|
|
|
Mg(OH)2 |
NaOH Na2SO4 |
称量过滤所得Mg(OH)2固体 |
③
19.(6分)某校的研究性学习小组进行测定混合物各组分质量比的研究,甲、乙、丙三位同学各设计了一种实验方案如下表所示:(混合物的质量事先已称量好)
|
实验 序号 |
混合物 |
第一步:加入适量水,充分溶解 |
第二步:加入或通入的试剂 |
第三步:过滤后洗涤干燥所得固体 |
第四步:蒸发滤液得到晶体 |
第五步:称量,记录数据 |
|
甲 |
BaCl2 NaCl |
澄清溶液 |
过量CO2 |
无固体 |
晶体 |
称量所得 晶体 |
|
乙 |
CaCl2 NaCl |
澄清溶液 |
过量饱和 Na2CO3溶液 |
CaCO3 |
NaCl |
称量蒸发 所得晶体 |
|
丙 |
Na2SO4 MgSO4 |
澄清溶液 |
过量NaOH 溶液 |
|
|
|
试回答下列问题:
①你认为甲同学设计的实验步骤中,根据称量所得到的数据, (填“能”或“不能”)准确计算出混合物中各组分的质量比。
②经讨论大家认为,乙同学所设计的实验步骤的第四步填写一定有错误。其原因是什么? 。
③丙同学对实验进行了较合理的设计,将其后三步相应内容仿照前面的形式填入对应的空格内。
18、(共9分)如图所示
+HCl +Na2O2① +Cu
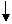






 A
D
A
D







 x加热 B
F
G
x加热 B
F
G
+NaOH +D 催化剂② +Cu




 C
E
C
E
图中每个字母表示有关的一种反应物或生成物,其中A、C为无色气体。请填写下列空白:
(1) 物质X可以是------------,C是------,F是------
(2) 反应①的化学方程式是----------------------------------------
反应②的化学方程式是----------------------------------------
18 X:(NH4)2CO3 或NH4HCO3 C:NH3 F:NO2
2CO2 + 2Na2O2 = 2Na2CO3 + O2↑
4NH3 + 5 O2 = 4 NO + 6H20(条件是加热、催化剂)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com