
题目列表(包括答案和解析)
28.(6分)A、B、C、D、E、F、G为由七种短周期元素构成的粒子,它们都 有10个电子,其结构特点如下表:
|
粒子代号 |
A |
B |
C |
D |
E |
F |
G |
|
原子核数 |
单核 |
单核 |
双核 |
多核 |
单核 |
多核 |
多核 |
|
电荷数 |
0 |
1+ |
1- |
0 |
2+ |
1+ |
0 |
其中,B的离子半径大于E的离子半径;D是由极性键构成的4原子极性分子;C常用作F的检验(加热)。请填写下列空白:
(1) A粒子的结构示意图 。
(2) 比较BC和EC2的碱性强弱BC EC2(填< 、> 、= )。
(3) F与C反应的离子方程式 。
27.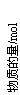
 (6分)某可逆反应从0-2分钟进行过程中,在不同反应时间各物质的量的变化情况如右图所示。则该反应的的反应物是
,生成物是 ,化学方程式为
(6分)某可逆反应从0-2分钟进行过程中,在不同反应时间各物质的量的变化情况如右图所示。则该反应的的反应物是
,生成物是 ,化学方程式为
;反应开始至2分钟时,能否用
C表示反应速率?若能,其反应速率为 ,
若不能,则其原因为_ ________________ ;
2分钟后A、B、C各物质的量不再随时间的变化而变化,说明在这个条件下,反应已达到了 状态。
26.(6分)A,B,C,D,E五种元素,它们的原子序数依次增大,A原子最外层有4个电子。B的阴离子与C的阳离子跟氟离子的电子层结构相同。E原子的M层上的电子数比次外层少1个电子。常温、常压下B单质是气体,0.1mol单质B与氢气完全反应时,有2.408×1023个电子发生转移。C的单质在高温下与B的单质充分反应之后,生成淡黄色固体F,F与AB2反应后可生成单质B。D的氢化物化学式是H2D,D的最高氧化物中含有40%的D,而且D原子是由相同数目的质子、中子、电子组成,根据以上的已知条件进行推测:
(1)下列元素的名称:D ,E 。
(2)写出下列的化学方程式:
B+C→F: ;
F与AB2反应: 。
24.(6分)H2O2、KCl、Na2SO4、Na2O2、HCl、O2中只含离子键的是 ,只含极性键的是 ,只含非极性键的是 ,既含离子键又含极性键的是
,既含离子键又含非极性键的是 ,既有极性键又有非极性键的是 。
 25.(6分)利用下列反应:Fe + 2Fe3+ = 3 Fe2+ 制一个化学电池(给出若干导线和一个小灯泡,电极材料和电解液自选),画出实验装置图,注明电解质溶液名称和正负极材料,标出电子流动方向和电流方向,写出电极反应式。
25.(6分)利用下列反应:Fe + 2Fe3+ = 3 Fe2+ 制一个化学电池(给出若干导线和一个小灯泡,电极材料和电解液自选),画出实验装置图,注明电解质溶液名称和正负极材料,标出电子流动方向和电流方向,写出电极反应式。
(1) 是正极,
正极的电极反应式: ;
(2) 是负极,
负极的电极反应式: 。
23.反应4A(g)+5B(g)  4C(g)+6D(g),在5 L的密闭容器中进行,半分钟后,C的物质的量增加了0.30 mol。下列叙述正确的是
4C(g)+6D(g),在5 L的密闭容器中进行,半分钟后,C的物质的量增加了0.30 mol。下列叙述正确的是
A.A的平均反应速率是0.010 mol·L-1·s-1 B.容器中含D物质的量至少为0.45 mol
C.容器中A的物质的量一定增加了0.30 mol
D.容器中A、B、C、D的物质的量的比一定是4∶5∶4∶6
选择题答题栏
第Ⅱ卷
22.在一定温度下,可逆反应A(气)+3B(气)?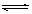 2C若达到平衡的标志是
2C若达到平衡的标志是
A.C的生成速率与B的生成速率相等 B.A、B、C的浓度不再发生变化
C.A、B、C的分子数之比为1∶3∶2 D.单位时间内生成A n mol,同时生成B 3n mol
21.根据下列事实:①X+Y2+=X2++Y;②Z+H2O(冷)=Z(OH)2+H2↑;③Z2+氧化性比X2+弱;④由Y、W电极组成的电池,电极反应为W2++2e-=W、Y-2e-=Y2+,可知X、Y、Z、W的还原性由强到弱的顺序为
A. X > Z > Y > W B. Z > W > X > Y C. Z > Y > X > W D. Z > X > Y > W
20.锂电池是一代新型高能电池,它以质量轻、能量高而受到了普遍重视,目前已研制成功多种锂电池。 某种锂电池的总反应式是Li+MnO2 = LiMnO2。下列说法正确的是
A. Li是负极,电极反应为Li-e-=Li+ B. MnO2是负极,电极反应为MnO2+e-=MnO2-
C. Li是正极,电极反应为Li+e-=Li- D. 锂电池是一种对环境有严重污染的原电池
19.在一个密闭容器中,盛有N2和H2,它们的起始浓度分别是1.8 mol·L-1和5.4 mol·L-1,在一定的条件下它们反应生成NH3,10min后测得N2的浓度是0.8 mol·L-1,则在这10min内NH3的平均反应速率是
A.0.2mol.L-1.min-1 B.0.3mol.L-1.min-1 C.0.4mol.L-1.min-1 D.0.6mol.L-1.min-1
18.在核电荷数为1-20的元素中,最外层电子数和电子层数相等的元素共有
A.3种 B.4种 C.5种 D.6种
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com