
题目列表(包括答案和解析)
7.以下元素的原子半径大小关系不正确的是(X表示原子,其左下标为相应的核电荷数)
A.4X > 5X B. 9X > 11X C. 3X > 1X D. 15X > 17X
6.不符合原子核外电子排布基本规律的是
A.核外电子总是优先排在能量较低的电子层上
B.K层是能量最低的电子层
C.N电子层为次外层时,最多可容纳的电子数为18
D.各电子层(n)最多可容纳的电子数为n2
5.某粒子用符号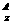 M
M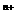 表示,下列关于该粒子的叙述中,正确的是
表示,下列关于该粒子的叙述中,正确的是
A.所含质子数为(A-n) B.中子数-电子数=A-2Z+n
C.所含电子数为(Z+n) D.所含中子数为(A-Z-n)
4.不能用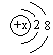 来表示其结构的微粒是
来表示其结构的微粒是
A.Ne B.F - C.Al3+ D.S 2 -
3.现代城市空气污染物之一NO主要来源于汽车尾气,汽车尾气中产生NO的原因是
A.汽车燃料油(如汽油、柴油)中含氮,NO是其燃烧产物
B.是空气中的N2和汽车燃料油发生了化学反应
C.空气中的N2与O2在汽车汽缸内的高温环境下发生反应的产物
D.是汽车排出的高温尾气导致空气中的N2和O2发生化合反应
2.下列电子式正确的是
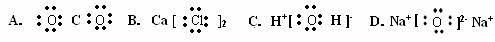
1.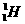 、
、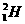 、
、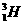 、H+、H2是
、H+、H2是
A.氢元素的五种不同粒子 B.五种氢元素
C.氢的五种同素异形体 D.氢的五种同位素
31.(6分)恒温下,将a mol N2与b mol H2的混合气
体通入一个固定容积的密闭容器中,发生如下反
 应:N2 (g) + 3 H2(g) 2NH3(g)
(1)若反应进行到某时刻t时,nt (N2)
= 13mol,nt (NH3)
= 6mol,计算a的值
(2)反应达平衡时,混合气体的体积为726.8L(标况下),其中NH3的含量(体积分数)为25%。
应:N2 (g) + 3 H2(g) 2NH3(g)
(1)若反应进行到某时刻t时,nt (N2)
= 13mol,nt (NH3)
= 6mol,计算a的值
(2)反应达平衡时,混合气体的体积为726.8L(标况下),其中NH3的含量(体积分数)为25%。
计算平移时NH3的物质的量。
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),n(始)∶n(平) = 。
(4)原混合气体中,a∶b = 。
(5)达到平衡时,N2和H2的转化率之比,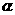 (N2)∶
(N2)∶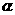 (H2)= 。
(H2)= 。
(6)平衡混合气体中,n(N2)∶n(H2)∶n(NH3) = 。
30.(5分)某元素X的碳酸氢盐 [X(HCO3)2] 在高温下完全分解的产物都是氧化物,现取3.24g这种碳酸氢盐高温完全分解后得到1.12g固体,又知X的原子核里有20个中子。
(1)通过计算确定X是什么元素,并写出它在元素周期表中的位置;
(2)写出X的单质与反应的化学方程式,已知该元素的金属性比钠强,但其单质与水反应没有钠那样剧烈,试分析其原因。
29.(10分)分析下列实例,根据已有的知识和经验,填写下表。
|
实 例 |
影响速率的因素 |
如何影响 |
|
夏天食物易变质 |
|
|
|
硫在氧气中比在空气中燃烧快 |
|
|
|
粉状的碳酸钙与盐酸反应 比块状的碳酸钙反应快 |
|
|
|
氯酸钾与二氧化锰混合共热可快速产生氧气 |
|
|
|
工业合成氨通常要在高压下进行 |
|
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com