
题目列表(包括答案和解析)
21.如下图各装置中均盛有海水,铁在其中被腐蚀由快到慢的顺序正确的是:
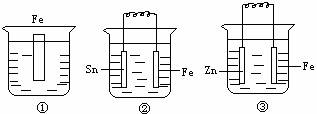
A.①>②>③ B.②>①>③
C.③>②>① D.②>③>①
20.电子表电源常用微型银-锌电池,电极分别是Ag2O和Zn,电解液为KOH溶液,电极反应为:Zn+2OH--2e-=ZnO+H2O,Ag2O+H2O+2e-=2Ag+2OH-,总反应为:Ag2O+Zn=2Ag+ZnO,根据上述变化下列判断正确的是:
A.Zn是负极,Ag2O是正极
B.Zn是正极,Ag2O是负极
C.工作时电子由Ag2O极经外电路流向Zn极
D.工作时,电池负极区溶液OH-浓度增大
19.现有一定条件下进行的反应:Cu+2H2O=Cu(OH)2+H2↑,有人想根据该反应设计原电池,下列说法正确的是:
A.可以铜为负极,碳为正极,氯化钠为电解质溶液构成原电池
B.可以铜为正极,碳为负极,氯化钠为电解质溶液构成原电池
C.可以铜为负极,碳为正极,稀硫酸为电解质构成原电池
D.该反应不能构成原电池
18.在恒温、恒容条件下,反应2A(g)+2B(g) C(g)+3D(g)从两条途径分别建立平衡。途径I:A、B的起始浓度为2mol·L-1;途径Ⅱ:C、D的起始浓度分别为2mol·L-1和6mol·L-1;则以下叙述正确的是:
C(g)+3D(g)从两条途径分别建立平衡。途径I:A、B的起始浓度为2mol·L-1;途径Ⅱ:C、D的起始浓度分别为2mol·L-1和6mol·L-1;则以下叙述正确的是:
A.两途径最终达到平衡时,体系内混合气的百分组成相同
B.两途径最终达到平衡时,体系内混合气的百分组成不同
C.达平衡时,途径Ⅰ的反应速率v1(A)等于途径Ⅱ的反应速率v2(A)
D.达平衡时,途径Ⅰ所得混合气的密度为途径Ⅱ所得混合气密度的2倍
17.已知氟化氢气体存在下列平衡:2H3F3 3H2F2,H2F2
3H2F2,H2F2 2HF
2HF
若平衡时混合气体的平均摩尔质量为42g/mol,则H3F3在平衡混合气中的体积分数为:
A.小于10% B.大于10% C.等于10% D.大于或等于10%
16.下列说法中,可以证明反应N2+3H2 2NH3已达到平衡状态的是:
2NH3已达到平衡状态的是:
A.1个N≡N键断裂的同时,有6个H-H键形成
B.1个N≡N键断裂的同时,有3个H-H键断裂
C.1个N≡N键断裂的同时,有6个N-H键断裂
D.1个N≡N键断裂的同时,有6个N-H键形成
15.反应C(s)+H2O(g) CO2(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是:
CO2(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是:
A.增加C的量 B.将容器的体积缩小一半
C.保持体积不变,升高温度 D.压强不变充入N2使容器体积增大
14.下列各组中每种物质都既有离子键又有共价键的一组是:
A.NaOH H2SO4 (NH4)2SO4 B.MgO Na2SO4 HNO3
C.Na2O2 KOH Na3PO4 D.HCl Al2O3 MgCl2
13.下列原子中,最容易形成阳离子的是

12.已知反应KClO3+ 6HCl = KCl + 3Cl2↑+ 3H2O,若用K35ClO3与H37Cl作用,下列说法中正确的是:
A.生成的Cl2相对分子质量约为73.3 B.该反应转移电子数为6
C.KCl中只含有35Cl D.KCl中同时含有35Cl和37Cl
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com