
题目列表(包括答案和解析)
4.下列物质的性质比较,正确的是 ( )
A.酸性:H2SO4>HClO4>HBrO4 B.碱性:NaOH>KOH>RbOH
C.非金属性: P>S>Cl D.气态氢化物稳定性:HF>HCl>H2S
3.某元素原子的最外层电子数是次外层电子数的3倍,且最外层电子数与次外层电子数之和小于10。该元素为( )
A.锂 B.铍 C.氧 D.钙
2.在地球上,氦元素主要以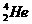 的形式存在。下列说法正确的是:( )
的形式存在。下列说法正确的是:( )
A.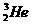 和
和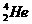 互为同位素 B.
互为同位素 B.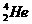 原子核内含有4个质子
原子核内含有4个质子
C.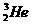 原子核内含有3个中子
原子核内含有3个中子
D.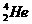 的最外层电子数为2,所以
的最外层电子数为2,所以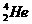 具有较强的金属性
具有较强的金属性
1.19世纪门捷列夫的突出贡献是 ( )
A.提出了原子学说 B.发现了元素周期律
C.发现了稀有气体 D. 提出了分子学说
27.由Cu片,Zn片和300mL稀H2SO4组成的原电池中,若锌片发生腐蚀,则当铜片上共放出3.36L(标况)的气体时,H2SO4恰好用完。
(1)有 个电子通过了导线。
(2)产生这些气体消耗锌多少克,原稀H2SO4的物质的量浓度为多少?
26.燃料电池具有高的发电效率,因而受到重视。
(1)可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气,制得在650℃下工作的燃料电池,完成有关的电池反应式:
 负极反应式:2CO+2CO32--4e-=4CO2
负极反应式:2CO+2CO32--4e-=4CO2
正极反应式:________________________;
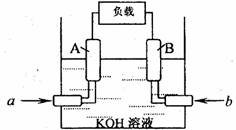
(2)某甲烷一氧气燃料电池的结构如图所示,该电池的两个电极均由多孔碳制成,以KOH溶液为电解质溶液,气体由多孔碳隙逸出并在电极表面放电,反应后溶液中K2CO3增多。写出该电池的负极反应式: ________________________;
25.在一个容积固定为2L的密闭容器中进行下列反应。
(1)将1 mol N2O4放入此容器,N2O4发生如下分解反应:
N2O4(g) 2NO2(g)(正反应吸热)
2NO2(g)(正反应吸热)
平衡时,测得混合气体(N2O4和NO2)的压强为同温下N2O4(g)尚未分解时压强的1.2倍,此时N2O4的体积分数为Φ。
平衡时容器内NO2和N2O4的物质的量之比为______________;升高温度,N2O4的分解率______________(增大或减小);
(2) 恒温时,向此容器内加入1 mol NO2,发生如下反应:2NO2(g) N2O4(g)。达到平衡时,其它条件不变,若向容器中分别增加①1
mol NO2或②1 mol N2O4,重新达到平衡后,与第一次平衡时相比,NO2的体积分数______________。
N2O4(g)。达到平衡时,其它条件不变,若向容器中分别增加①1
mol NO2或②1 mol N2O4,重新达到平衡后,与第一次平衡时相比,NO2的体积分数______________。
A. ①②都增大 B. ①②都减小 C. ①增大,②减小 D. ②增大,①减小
(3) 恒温时,向此容器内加入x mol NO2 和y mol N2O4(y≥0),若要使平衡后N2O4的体积分数仍为Φ,且反应朝着逆反应方向进行,则x的取值范围是___________________。
24.下表中的数据是破坏1 mol物质中的化学键所吸收的能量(kJ)。这一数据的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热,反应热等于反应中断裂旧化学键消耗的能量之和与反应中形成新化学键放出的能量之和的差。
|
化学键 |
Cl2 |
Br2 |
I2 |
HCl |
HBr |
HI |
H2 |
|
能量(kJ) |
243 |
193 |
151 |
432 |
366 |
298 |
436 |
回答下列问题:
(1)在HCl、HBr、HI中,最稳定的是__________;
(2)对于反应X2 + H2=2HX(X2代表Cl2、Br2、I2),相同条件下,消耗等量氢气时,放出热量最多的是__________;
(3)反应Br2 + H2=2HBr,当生成2 mol HBr时放出_________ kJ能量。
23.下表是周期表中的一部分,根据A-I在周期表中的位置,用元素符号或化学式回答下列问题:
 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
|
1 |
A |
|
||||||
|
2 |
|
|
|
D |
E |
|
G |
|
|
3 |
B |
|
C |
J |
F |
|
H |
I |
(1)表中元素,化学性质最不活泼的是 ,可用于制半导体材料的元素是_______。
(2)最高价氧化物的水化物碱性最强的是 ,酸性最强的是 ;(填写最高价氧化物的水化物的化学式)
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的 。
22.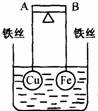 如右图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化):
如右图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化):
A.杠杆为导体和绝缘体时,均为A端高B端低
B.杠杆为导体和绝缘体时,均为A端低B端高
C.当杠杆为绝缘体时,A端低,B端高;为导体时,A端高,B端低
D.当杠杆为绝缘体时,A端高,B端低;为导体时,A端低,B端高
第II卷(非选择题 共34分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com