
题目列表(包括答案和解析)
34.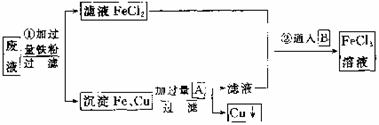 (8分)某工业废液里含有FeCl2、CuCl2和FeCl3。为回收铜并得到纯净的FeCl3溶液,下面是综合利用的主要流程:
(8分)某工业废液里含有FeCl2、CuCl2和FeCl3。为回收铜并得到纯净的FeCl3溶液,下面是综合利用的主要流程:
(1)方框内物质A和B的化学式:A ,B 。
(2)根据图示第①步的有关离子方程式为 。
(3)第②步的化学方程式为 。
33.(12分)已知A.B.C.D分别是AlCl3、BaCl2、FeSO4、NaOH四种化合物中的一种,它们的水溶液之间的一些反应现象如下:
①A+B→白色沉淀,加入稀硝酸,沉淀不溶解。
②B+D→白色沉淀,在空气中放置,沉淀由白色转化为红褐色。
③C+D→白色沉淀,继续加D溶液,白色沉淀逐渐消失。
⑴ 则各是什么物质的化学式为:A 、B 、C 、D 。
⑵现象②中所发生的反应的化学方程式为:
、 。
⑶现象③中所发生反应的离子方程式为:
、 。
32. (8分)某学生课外活动小组利用右图所示装置分别做如下实验:
(8分)某学生课外活动小组利用右图所示装置分别做如下实验:
(1)在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅,冷却后恢复红色,则原溶液可能是________________溶液;加热时溶液由红色逐渐变浅的原因是:___________________________________ ______。
(2)在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是________________溶液;加热时溶液由无色变为红色的原因是
。
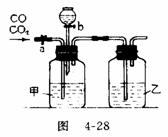
31.(5分)某学生用图4-28的装置进行一氧化碳和二氧化碳混合气体的分离和干燥。其中a为铁夹,b为分液漏斗的活塞。
(1)甲瓶内盛 溶液,乙瓶内盛 溶液,分液漏斗内盛 溶液。
(2)实验先分离出一氧化碳,方法是先关闭 ,再打开 。
(3)分离完一氧化碳后,再收集二氧化碳,方法是先关闭 ,再打开 。
30.(10分)除去下列物质中所混有的少量杂质,指明应加入的试剂和使用的分离方法,写出有关的反应方程式。
(1)铜粉中混有少量铝粉 ;
 (2) FeCl3中混有少量FeCl2
;
(2) FeCl3中混有少量FeCl2
;
(3)Na2CO3中混有少量NaHCO3 。
29.(7分)(1)正常雨水显 性,其pH约值等于 ,这是由于 ____ 。
(2)某次采集的酸雨样品,每隔一段时间测定一次pH值,得数据如下
|
时间 |
开始 |
8h后 |
16h后 |
24h后 |
32h后 |
40h后 |
48h后 |
|
pH |
5.0 |
4.8 |
4.6 |
4.3 |
4.2 |
4.0 |
4.0 |
酸雨样品pH值变小的主要原因是 __________
__________ 。
28.(3分)Cl2和SO2都有漂白作用,现将二者以等物质的量混合后再通入到品红溶液中,品红溶液将 (填褪色或不褪色),反应方程式为:
____ 。
27.(4分).实验室制取Cl2的反应方程式为:MnO2 + 4HCl (浓)  MnCl2 + Cl2↑+ 2H2O。从氧化还原反应的角度看,在制备H2、CO2、Cl2三种气体时,盐酸的作用分别是
__
、 _____ 、 _______
。
MnCl2 + Cl2↑+ 2H2O。从氧化还原反应的角度看,在制备H2、CO2、Cl2三种气体时,盐酸的作用分别是
__
、 _____ 、 _______
。
26.(9分)(1)0.5 mol H2O的质量为 ,其中含有 个水分子,共有 个原子。
(2)质量都是50 g的 HCl、NH3、CO2、O2四种气体中,含有分子数目最少的是 _ ,在相同温度和相同压强条件下,体积最大的是 ,体积最小的是 。
(3)在 mL 0.2 mol/L NaOH溶液中含1 g溶质;配制50 mL 0.2 mol/L CuSO4溶液,需要CuSO4·5H2O ____ g。
(4)中和相同体积、相同物质的量浓度的NaOH溶液,并使其生成正盐,需要相同物质的量浓度的盐酸、硫酸、磷酸(H3PO4)溶液的体积比为 。
25. 按右图装置持续通人气体x,并在管口P处点燃,实验
按右图装置持续通人气体x,并在管口P处点燃,实验
结果使澄清石灰水变浑浊,则X、Y可能是…( )
① H2和NaHCO3磺 ②CO和Na2CO3 ③CO和CuO
④H2和Fe2O3
A. ①② B. ①③ C. ②③ D. ③④
Ⅱ非选择题(共80分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com