
题目列表(包括答案和解析)
22.(10分)在盛有NaI、AgNO3、CaCl2、K2CO3、HBr的已失去标签的五种无色溶液的试剂瓶上,分别贴上①②③④⑤的编号,使它们两两反应,产生的现象在下表中列出。请在表中的结论格内,填写这些编号所代表的物质的名称。
|
|
① |
② |
③ |
④ |
⑤ |
|
① |
-- |
无色↑ |
白色↓ |
白色↓ |
无 |
|
② |
无色↑ |
-- |
无 |
浅黄↓ |
无 |
|
③ |
白色↓ |
无 |
-- |
白色↓ |
无 |
|
④ |
白色↓ |
浅黄↓ |
白色↓ |
-- |
黄色↓ |
|
⑤ |
无 |
无 |
无 |
黄色↓ |
-- |
|
结论 |
|
|
|
|
|
21.(12分)已知SnCl4、SiCl4、AlCl3、PCl3等氯化物在潮湿的空气中都能产生白雾。为清楚地观察磷在Cl2中燃烧,达到PCl3(常温下液态)和PCl5(常温下固态)分步生成的目的,可预先把干燥的Cl2贮存在100 mL的注射器内,再把火柴头大小的红磷置于玻璃燃烧匙上烘干后,组成如上图所示的装置。操作时打开弹簧夹,缓缓推动注射器的针塞,待磷燃烧出现白雾时,立即关闭弹簧夹,停止推入Cl2,片刻后,可观察到试管内白雾凝成无色液滴附着在试管内壁。然后再打开弹簧夹,继续推入Cl2,就可看到管壁上液滴逐渐消失,管内出现白雾,最后白雾凝结成白色固体附着在试管内壁上。试回答:

(1)该实验选择玻璃燃烧匙,不选其他金属燃烧匙的原因是______________;
(2)该实验的关键是使用的Cl2和红磷必须干燥,分析原因。(请用必要的文字和化学方程式说明)______________;
(3)第二次推入Cl2时发生的反应是(用化学方程式表示)______________,故第一次推入Cl2之所以要缓缓进行的原因是______________。
20.(8分)水污染问题是当前全世界关注的焦点问题。我们每一个人都应该自觉地保护水资源,防止污水的随意排放。化学实验过程中往往会产生污水,污水中的重金属离子如Cu2+、Ba2+、Ag+对水的污染作用很强。
某次化学实验后,回收的废液中可能含有Cu2+、Ba2+、Ag+。
(1)你认为应对该废液进行怎样的处理后才能够倒掉?
(2)写出你设计的废液处理方案及相关反应的化学方程式。
19.(6分)在配制一定量的物质的量浓度溶液时,下列操作使得到的溶液浓度偏高、偏低还是不变?
(1)用量筒取液态溶质,读数时俯视量筒,所配溶液浓度_______。
(2)将取样品的药匙用水洗涤,洗涤液倒入容量瓶,所配溶液浓度_______。
(3)定容摇匀后,有少量溶液外流,所配溶液浓度_______。
18.如图装置可以用来发生、洗涤、干燥、收集(不考虑尾气处理)气体。该装置可用于
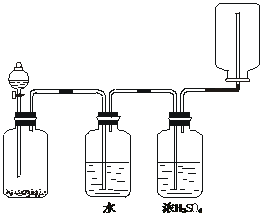
A.锌和盐酸生成氢气
B.二氧化锰和浓盐酸生成氯气
C.碳酸钙和盐酸生成二氧化碳
D.氯化钠和浓硫酸生成氯化氢
第Ⅱ卷 (非选择题 共54分)
17.在无土栽培中,要配制10 L含0.5 mol·L-1 NH4Cl、0.16 mol·L-1 KCl、0.24 mol·L-1
K2SO4的某营养液,现因无现成的KCl、K2SO4药品,而要用KCl、NH4Cl、(NH4)2SO4 三种固体配制,则需此三种固体的物质的量(mol)分别为
A.0.64、0.02、0.24 B.6.4、5.0、2.4
C.4.0、5.5、1.8 D.6.4、0.2、2.4
16.下列说法正确的是
A.1 mol O2占有的体积约为22.4 L
B.22.4 L N2含阿伏加德罗常数个氮分子
C.在标准状态下,22.4 L水的质量约为18 g
D.22 g二氧化碳与标准状况下11.2 L HCl含有相同的分子数
15.卤素从F到I性质递变规律正确的是
①单质的氧化性增加 ②单质颜色加深 ③单质沸点升高 ④气态氢化物稳定性增强 ⑤气态氢化物水溶液酸性增强 ⑥离子半径逐渐增大,还原性逐渐增强
A.①③⑤ B.②④⑥ C.②③⑤⑥ D.①④⑤⑥
14.在100 g 10%的盐酸和100 g 15%的盐酸中,分别加入2.3 g钠,钠全部反应后产生的气体
A.一样多
B.在浓度大的盐酸中反应产生的气体多
C.在浓度小的盐酸中反应产生的气体多
D.由反应剧烈程度决定
13.精确配制一定物质的量浓度的NaOH溶液,下面实验操作正确的是
A.称量时,将NaOH固体直接放在天平托盘上面的纸上
B.将称好的NaOH固体放入容量瓶中,加入少量水溶液
C.在烧杯中溶解NaOH固体后,立即将溶液注入容量瓶中
D.将烧杯中已冷却的NaOH溶液注入未经干燥的容量瓶中
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com