
题目列表(包括答案和解析)
25.按以下装置图进行实验,填写有关现象及化学方程式。
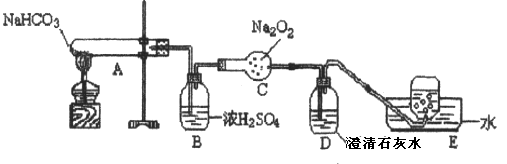
①A中现象是
②B中浓硫酸的作用是
③C中发生反应的化学方程式为
④D中现象是____________________,反应的离子方程式是
⑤E中收集的气体是______________。
24.(8分)下图中A至F是化合物,G是单质
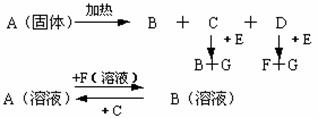
(1)写出A、B、E、F的化学式:A B E F
(2)写出下列反应的化学方程式。
D+E→F+G:
(3)若B溶液中混有F,检验有F的实验方法是
23.(9分)用双线桥标出下列反应的电子转移方向和数目:
(1) 2Na2S + Na2SO3 + 3H2SO4(稀)= 3S + 3Na2SO4 + 3H2O,
氧化产物与还原产物的质量之比为: 。
(2) 3BrF3 + 5H2O = 9HF + Br2 + HBrO3 + O2
氧化剂是: ;还原剂是: 。
22.(9分)填表:
|
实验操作 |
实验现象 |
离子反应方程式 |
|
一小块钠投入FeCl3溶液中 |
|
|
|
醋酸溶液加入到大理石里 |
|
|
|
少量小苏打溶液加入到过量的澄清石灰水中 |
|
|
21.(7分)碱金属原子的最外电子层都有______个电子,容易_______(填“失去”或“得到”)电子形成稳定的离子结构,表现化合价为______价;在Li、Na、K、Rb、Cs等五种元素中,随着核电荷数的增加,原子半径_____________,原子核对核外电子的引力____________,元素的原子失去电子的能力__________,氧化物的水化物碱性最强的是_____________。
20.氢化钙(CaH2)是一种白色的离子晶体,其中钙是+2价。CaH2与水反应放出氢气。下列叙述正确的是
A.CaH2在水中显酸性 B.CaH2中氢离子的电子层排布与氦原子的相同
C.CaH2中氢离子具有氧化性 D.氢气既是氧化产物又是还原产物
第 II 卷(非选择题,共55分)
19.当质量为a g的某碱金属单质X与足量的氯气反应时,生成氯化物质量为(a+35.5) g,若将等质量的碱金属单质X与氧气反应,生成化合物的质量可能为
A.(a+8)g B.(a+16)g C.(a+24)g D.(a+64)g
18.用一种试剂和必要的实验操作就能鉴别NaHCO3、NaCl、KCl、K2SO4四种物质,此试剂与实验操作是
A.盐酸、焰色反应 B.Ba(OH)2溶液、焰色反应
C.盐酸、加热 D.BaCl2溶液、焰色反应
17.下列各组微粒中,在一定条件下均可以做氧化剂的是
A.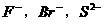 B.
B.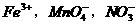
C.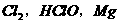 D.
D.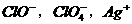
16.一定温度下,向饱和NaOH溶液中投入一小块金属钠,充分反应后恢复到原来温度。下列叙述中,合理的是
A.NaOH溶液浓度增大,并放出H2 B.溶液中NaOH的质量分数不变,有H2放出
C.总溶液的质量减小,有H2放出 D.总溶液的质量不变,有H2放出
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com