
题目列表(包括答案和解析)
22.(9分)将一块表面已被氧化成氧化钠的钠块投入水中,完全反应后收集到气体224mL(标准状况),得到100mL溶液,向上述溶液中逐滴滴加1mol·L-1的稀盐酸30mL恰好完全中和。
(1)写出钠与水发生反应的离子方程式,并标出电子转移的方向和数目。
(2)求钠块中金属钠的质量。
(3)计算所得NaOH溶液的物质的量浓度。

21.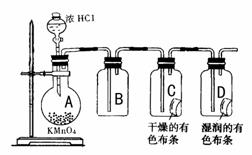 (12分)某学习小组通过上网查阅资料得知:实验室可以用KMnO4与浓盐酸在常温下反应制取氯气,其反应的化学方程式为2KMnO4+16HCI(浓)=2KCI+2MnCl2+5Cl2↑+8H2O ,据此,他们设计了以下实验方案探究Cl2的性质。
(12分)某学习小组通过上网查阅资料得知:实验室可以用KMnO4与浓盐酸在常温下反应制取氯气,其反应的化学方程式为2KMnO4+16HCI(浓)=2KCI+2MnCl2+5Cl2↑+8H2O ,据此,他们设计了以下实验方案探究Cl2的性质。
(1)实验时甲同学在B装置中未加入任何试剂,发现C、D中的红色纸条均褪色,由此甲同学得出结论:氯气具有漂白性。
实验时乙同学向B装置中加入了某种试剂,发现C中的红色纸条不褪色而D中的红色纸条褪色,由此乙同学得出结论:氯气没有漂白性。
你认为乙同学向B装置中加入的试剂是 ,甲、乙两同学谁的结论合理?
(2)丙同学思考后认为上面的实验装置存在缺陷,并提出了解决方法。
你认为存在的缺陷是 ,解决方法(用离子方程式表示)
。
(3)丁同学在B装置中加入滴有酚酞的NaOH溶液,观察到B装置中溶液红色逐渐褪去。他提出两种可能的原因:①氯气与水反应成次氯酸,次氯酸具有强氧化性,将酚酞氧化使溶液褪色;②氯气与NaOH反应使溶液褪色。请你帮他设计一个简单的实验验证褪色原因(简述实验步骤)。
。
29.(15分)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔。制造印刷电路板。对腐蚀废液的处理某工程师采用了下列实验方案:
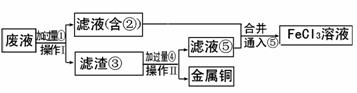
(1)加入的过量①物质的化学式是 ,写出主要反应的化学方程式
(2)滤渣③的成分是 ,操作II的名称 ,加过量④反应的离子方程式
(3)将②⑤合并通入⑥后,溶液颜色的变化为 ,该反应的离子方程式
(4)该实验方案的目的是
19.(10分)随着人们生活水平的不断提高,健康美容日益得到重视。皮肤的黑白与皮肤中黑色素的多少有关。合理的饮食能够减少黑色素的合成,有利于皮肤变白。化学实验证明,黑色素形成的一系列反应多为氧化反应,多食入富含维生素C的食物,如酸枣、番茄、柑橘、新鲜绿叶蔬菜等可阻断黑色素的形成。这是利用了维生素C的 ① 性。其实验需要用1.0mol·L-1维生素C 溶液450mL。配制该溶液所需的玻璃仪器有 ②
配制实验操作步骤有:①在天平上称量一定量的维生素C放入烧杯,加水溶解,冷却至室温。②把制得的溶液小心地注入一定容积容量瓶中。③继续向容量瓶中加水至距刻度线1cm~2cm处,改用胶头滴管加水至刻度线。④用少量水洗涤烧杯和玻璃棒2~3次,每次将洗涤液转入容量瓶,并摇匀。⑤将容量瓶塞塞紧,充分摇匀。填写下列空白:
①操作步骤和正确顺序为 ③ 。
②该配制过程中两次用到玻璃棒,其作用分别是 ④
③定容时,若俯视凹液面,会使结果 ⑤
④若没有进行④步操作,会使结果 ⑥
⑤在进行②操作时,不慎有液体溅出,应怎样处理才能达到实验的主要目的? ⑦ 。
18.(8分)下表是生活生产中常见的物质,表中列出了它们的一种主要成分 (其它成分未列出)
|
编号 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
|
名称 |
绿矾 |
醋精 |
苏打 |
酒精 |
铜导线 |
蔗糖 |
烧碱 |
|
主要成分 |
FeSO4 |
CH3COOH |
Na2CO3 |
CH3CH2OH |
Cu |
C12H12O11 |
NaOH |
(1)请你对表中①-⑦的主要成分进行分类(填编号)
属于盐的是 属于电解质的是 属于非电解质的是
(2)写出②与⑦反应的化学方程式
过量盐酸与③反应的离子方程式
17.已知0.5L盐酸和硫酸混合溶液中含有0.1mol Cl-和0.2mol SO42-,则此溶液中H+的物质的量浓度为:( )
A.1mol·L-1 B. 0.6mol·L-1 C. 0.5mol·L-1 D. 0.1mol·L-1
第II卷 (非选择题 共54分)
16.下列反应既属于氧化还原又属于离子反应的有 ( )
A.锌和稀硫酸反应 B. H2和O2点燃反应生成水
C.H2和CuO加热反应 D. CuSO4溶液中加入NaOH溶液
15.在5KCl+KClO3+3H2SO4=3Cl2↑+3K2SO4+3H2O中被氧化与被还原的氯元素的质量比为 ( )
A.1:1 B. 1:5 C. 5:1 D. 3:1
14.只用一种试剂就可AgNO3、KSCN、 稀H2SO4、NaOH四种无色溶液区分开,这种试剂是 ( )
A.BaCl2溶液 B. FeCl2溶液
C.FeCl3溶液 D.Fe(NO3)3溶液
13.下列离子方程式书写正确的是: ( )
A.稀硫酸跟铁反应
Fe+6H+=2Fe3++3H2↑
B.稀硫酸与氢氧化钡溶液反应:
H++OH-=H2O
C. 碳酸钙放入稀盐酸中
CO32+2H+=CO2↑+H2O
D.氯气溶于水中
Cl2+H2O=H++Cl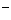 +HC1O
+HC1O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com