
题目列表(包括答案和解析)
4. 把下列四种X溶液分别加入四个盛有10ml2mol/L盐酸的烧杯中,均加水稀释到50ml,此时,X和盐酸缓慢地进行反应,其中最快的是
A、10℃ 20ml 3mol/L的X溶液
B、20℃ 30ml 2mol/L的X溶液
C、20℃ 10ml 4mol/L的X溶液
D、10℃ 10ml 2mol/L的X溶液
3. 近年来,科学家在海洋中发现了一种冰状物质――可燃冰,其有效成分是甲烷。下列说法正确的是
①甲烷属于烃类 ②在相同条件下甲烷的密度大于空气 ③甲烷难溶于水
④可燃冰是一种极具潜力的能源
A、①②③ B、②③④ C、①③④ D、①②④
2. 下列物质在稀硫酸存在的条件下进行水解,最后生成物只有一种有机物的是
A、蔗糖 B、淀粉 C、 蛋白质 D、 油脂
1. 现行元素周期表中已列出112种元素,其中元素种类最多的周期是
A、第四周期 B、第五周期 C、第六周期 D、第七周期
33、实验室可用氯酸钾与浓盐酸反应制取氯气,该反应的化学方程式为: KClO3+6HCl(浓)====KCl+3H2O+3Cl2↑。现将24.5g KClO3跟150mL 12mol/L(过量)盐酸充分反应,求:
⑴生成Cl2的在标准状况下体积为多少升?
⑵将反应后混合液稀释至500mL,此时溶液中Cl-的物质的量浓度为多少?
(KClO3摩尔质量为122.5g/mol)
解:
32、有A、B、C、D、E五种主族元素,其原子的最外层电子数依次为1、3、7、6、4,原 子序 数按E、B、D、C、A的顺序依次增大.D的最高价氧化物的式量与气态氢化物的式量之比为2. 35∶1,且该原子核内质子和中子相等,A、B、C原子的次外层都有8个电子,E原子的次外层有2 个电子.
(1)计算D的原子量 ;
(2)画出D的原子结构示意图 ;
(3)写出元素符号:A、 B、 C、 D、 E、 ;
(4)按酸性由强到弱、碱性由弱到强的顺序写出它们最高价氧化物对应水化物的化学式 ;
(5)A和B两元素的最高价氧化物对应水化物相互反应的离子方程式为:
31、有A、B、C、D四种元素,A元素形成的-2价阴离子比氦的核外电子数多8个。B元素的一种氧化物为淡黄色固体,该固体遇到空气能生成A的单质。C原子核内有12
个中子的二价金属,当2.4gC与足量热水反应时,在标准状况下放出2.24LH2。D的M
层上有7个电子。回答下列有关问题:
(1)A、B、C、D 各是什么元素:
A_____________B_____________C_____________D _____________
(2)淡黄色固体的电子式为: 。
(3)淡黄色固体遇到空气能生成A的单质的化学方程式为:
;
30、某无色透明的澄清溶液,可能含有较大量的Cu2+、OH-、NO3-、Cl-、HCO3-、H+、K+等离子中的两种或多种,现进行如下实验:
①取溶液少量加入碳酸钠粉末有无色无味气体放出;
②另取原溶液少许,加入硝酸银溶液无沉淀生成。
(1)由此判断原溶液中一定含有的离子是 ;一定不含有的离子是
;可能含有的离子是 。
(2)为了检验上述溶液中可能含有的离子是否一定存在,你认为还应该继续进行的实验操作是: ;对应的实验现象和结论是
。
29.有下列四种微粒:①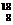 O、②
O、②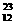 Na、③
Na、③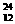 Mg、④
Mg、④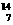 N
N
(1)按原子半径由大到小顺序排列为__________________________(用序号填空,下同)
(2)微粒中质子数小于中子数的是______________________________
(3)在化合物中呈现的化合价的数值最多的是____________________
(4)能形成X2Y2型化合物的是___________,能形成X3Y2型化合物的是___________。
28、元素周期律是指元素的性质随___________的递增,而呈_______性变化的规律,这
里元素的性质主要是指_____________和_____________;元素性质周期性变化是__________________________呈周期性变化的必然结果。 是元素周期律的具体表现形式,主族元素的最高正化合价一般等于其 电子数,非金属元素的负化合价等于 ;同一周期中,从左到右,金属性逐渐
,非金属元素逐渐 ;同一主族中,从上到下,金属性逐渐
,非金属元素逐渐 ;金属性最强的元素是 ,非金属元素最强的元素是 (不考虑放射性元素)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com