
题目列表(包括答案和解析)
7、下列叙述不正确的是 A、同主族金属的原子半径越大,熔点越高 B、稀有气体原子序数越大,沸点越高 C、分子间作用力越弱,该分子的熔点越低 D、同周期元素的原子半径越小,越容易得到电子 8、已知氢化锂(LiH)属于离子晶体,LiH跟水反应可以放出氢气,下列叙述正确的是 A、LiH的水溶液显酸性 B、LiH是一种强氧化剂 C、LiH中的氢离子可以被还原成氢气 D、LiH中氢离子与锂离子的核外电子排布相同 9、A、B、C、D为四种短周期元素,已知A、C同族,B、D同周期,A的气态氢化物比
C的气态氢化物稳定;B的阳离子比D的阳离子氧化性强;若B的阳离子比C的阴离子
少一个电子层,下列叙述不正确的是 A.原子序数:A>B>D>C B.单质熔点:D>B,C>A C.原子半径:D>B>C>A D.简单离子半径:C>A>D>B
6、氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:Al2O3+N2+3C 2AlN+3CO,下列叙述不正确的是
A.在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中每生成2 mol AlN,N2得到6 mol电子
C.氮化铝中氮元素的化合价为-3
D.氮化铝晶体属于共价化合物
2AlN+3CO,下列叙述不正确的是
A.在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中每生成2 mol AlN,N2得到6 mol电子
C.氮化铝中氮元素的化合价为-3
D.氮化铝晶体属于共价化合物
5、已知X、Y、Z三种主族元素在周期表中的相对位置如图所示,且X的原子序数为a,
下列说法不正确的是
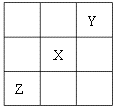
A.Y、Z的原子序数之和可能为2a B.Y的原子序数可能是a-17 C.Z的原子序数可能是a+31 D.X、Y、Z一定都是短周期元素
4、有M、R两种主族元素,已知R2-离子与M+离子核外电子数之和为20,则下列说法
中不正确的是 A.R与M的质子数之和一定等于19 B.若R处于第三周期,则M必处于第二周期 C.R与M元素组成的某种离子化合物中存在非极性共价键 D.R与M的质子数之差可能等于7
3、下列说法正确的是 A.白磷与红磷在一定条件下互相转化,发生的是物理变化 B.干冰气化时,需要破坏共价键 C.能与酸反应的氧化物一定是碱性氧化物 D.金属阳离子被还原不一定得到金属单质
正确的是
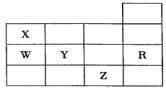
A、常压下五种元素的单质中Z单质的沸点最高 B、Y、Z的阴离子电子层结构都与R原子的相同 C、W的氢化物的沸点比X的氢化物的沸点高 D、Y元素的非金属性比W元素的非金属性强
2、据报道,科学家已成功合成了少量N4,有关N4的说法正确的是 A.N4是N2的同素异形体 B.N4是N2的同分异构体 C.相同质量的N4和N2所含原子个数比为1:2 D.N4的摩尔质量是56g
26. (9分)有原子量均大于10的A、B两种元素,它们之间可形成化合物X和Y.已知等物质的量的X和Y的混合物的密度是相同条件下H2密度的18.5倍,其中X与Y的质量比为3∶4.4,经测定X的组成为AB,Y的组成为A2B.试通过计算确定A、B是什么元素.
25. (8分)某元素的同位素AZX,它的氯化物XCl2 1.11g溶于水制成溶液后, 加入1mol/L的AgNO3溶液20mol恰好完全反应.若这种同位素原子核内有20个中子,求:
(1)Z值和A值;
(2)X元素在周期表中的位置;
(3)把X的单质放入水中,有何现象?写出反应的化学方程式.
24、(9分)通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
化学键 P-H Si-Cl H-H P-P Si-Si Si-C
键能/ KJ•mol-1 326 360 436 197 176 347
请回答下列问题:
⑴比较下列各组物质的熔点高低(填>或<或=)
SiC___________Si;Si(晶体)____ _________P(白磷);HCl____________HF;
⑵试说明比较HCl与HF熔点高低的依据:________________。
⑶液态有机物2.3g和一定量的氧气混合点燃,恰好完全燃烧,生成2.7gH2O和2.24LCO2(标准状况)并放出68.35kJ的能量,则该反应的热化学方程式为:________________。
23、(8分)不同元素的气态原子失去最外层一个电子所需要的能量(设其为E)如图所示。试根据元素在周期表中的位置,分析图中曲线的变化特点,并回答下列问题。
⑴同主族内不同元素的E值变化的特点是:________________。
各主族中E值的这种变化特点体现了元素性质的________________变化规律。
⑵同周期内,随原子序数增大,E值增大。但个别元素的E值出现反常现试预测下列关系式中正确的是________________(填写编号,多选倒扣)
①E(砷)>E(硒) ②E(砷)<E(硒)
③E(溴)>E(硒) ④E(溴)<E(硒)
⑶估计1mol气态Ca原子失去最外层一个电子所需能量E值的范围:______<E<_____
⑷10号元素E值较大的原因是________________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com