
题目列表(包括答案和解析)
下列物质中:①NaCl溶液 ②硫酸 ③浓硫酸④Cu ⑤CH3COOH ⑥NaOH固体 ⑦蔗糖 ⑧石灰水 ⑨水银 ⑩食盐、⑾CuSO4•5H2O 、⑿小苏打、⒀大理石、⒁生石灰、⒂铝、⒃熔融的MgCl2、⒄酒精 ⒅纯碱、⒆烧碱。
其中能够导电的物质是: ,
属于电解质的是: 。
(2)在一定条件下,RO3 n―和I―发生反应的离子方程式为: RO3 n― + 6I― + 6H+ = R― + 3I2 + 3H2O
RO3 n―中R元素的化合价是__________________;
(3).(2003年广东省高考化学第7题)在一定条件下,RO3n-和氟气可发生如下反应:
RO3n-+F2+2OH-=RO4-+2F-+H2O。从而可知在RO3n-中,元素R的化合价是
A、+4 B、+5 C、+6 D、+7
21. (附加题,20分)A、B、C、D、E、F六种短周期元素的原子序数依次增大,已知:
①A原子核内只有1个质子;②B原子最外层电子数是次外层电子数的2倍;③C原子最外层电子数比次外层电子数多4个;④D原子的次外层电子数是最外层电子数的8倍;⑤E单质既能和盐酸反应又能和烧碱反应;⑥F与C同主族。用化学符号或化学用语回答下列问题: (1)用电子式表示下列物质A2C2 ,DCA_________________; (2)用电子式表示D与F形成化合物的过程 ; (3)用“化学式”和“<或>”比较: A与C、A与F形成化合物的稳定性 ;沸点的高低 , 沸点高低的原因 ; (4)写出E与烧碱反应的离子方程式 。 (5)用A元素的单质与C元素的单质可以制成电池,电池中装有KOH浓溶液,用多孔的金属惰性电极浸入KOH溶液,两极均有特制的防止透过的隔膜,在a极通入A的单质,b极通入C的单质,a极的电极反应式是 ;b极的电极反应式是 。若改为H2SO4作电解质溶液,则a极的电极反应式是 ;b极的电极反应式是 。
20. (9分)利用碳棒、锌片和200ml稀硫酸组成原电池。当碳棒上共产生3.36L(标准状况)气体时,硫酸恰好被消耗掉一半。试计算: (1)产生这些气体消耗了多少g锌? (2)有多少个电子通过了导线。 (3)原稀硫酸溶液的物质的量浓度。
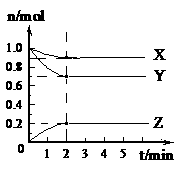
19. (6分)某温度时,在5 L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如右图所示。请通过计算回答下列问题。 (1)反应开始至2 mim,Y的平均反应速率 。 (2)分析有关数据,写出X、Y、Z的反应方程式 。
18. (11分)市场出售的“热敷袋”,其主要成分是铁屑、炭粉、木屑与少量氯化钠、水等。它在使用之前需用塑料袋与空气隔绝。使用时开启塑料袋的小气孔,轻轻揉搓就会放出热量来。当使用完后还会发现有铁锈生成,依上述现象完成下列问题: (1)“热敷袋”放出热量时铁发生了 反应(填“氧化”或“还原”)。
(2)炭粉的主要作用是 。 (3)加入氯化钠的作用是 。 (4)写出有关的电极反应与化学方程式来表明上述过程: 负极 ;正极 。
 溶液中的离子反应
。
在空气中形成铁锈的反应
。
溶液中的离子反应
。
在空气中形成铁锈的反应
。
17. (6分)电子表和电子计算器常用微型银-锌原电池,其电极分别为Ag2O和Zn,电解质溶液是KOH溶液,电极反应分别为: Zn+2OH--2e- =ZnO+H2O Ag2O+H2O+2e- =2Ag+2OH- 总的化学方程式为 。 根据上述变化判断:正极为 ;负极为 。
16.
(8分)
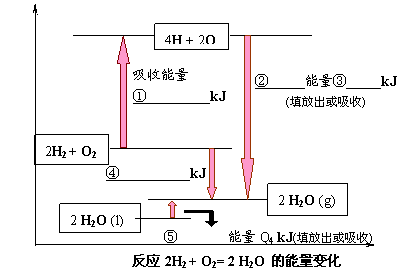 化学反应可视为旧键断裂和新键形成的过程。现提供H2燃烧反应中有关物质的化学键键能: H-H Q1kJ/ mol、H-O Q3kJ/
mol、O2分子内氧原子间的键能为Q2kJ/mol。
(1)请根据上述数据,在下图中标注的数字处,填出能量变化的数值或根据箭头的指向填写能量变化是“放出”热量还是“吸收”热量。
(2)请写出1molH2燃烧生成液态水的热化学反应方程式:
。
化学反应可视为旧键断裂和新键形成的过程。现提供H2燃烧反应中有关物质的化学键键能: H-H Q1kJ/ mol、H-O Q3kJ/
mol、O2分子内氧原子间的键能为Q2kJ/mol。
(1)请根据上述数据,在下图中标注的数字处,填出能量变化的数值或根据箭头的指向填写能量变化是“放出”热量还是“吸收”热量。
(2)请写出1molH2燃烧生成液态水的热化学反应方程式:
。
15.
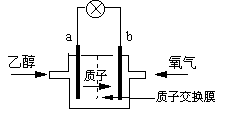 2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200oC左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全。电池总反应为:
C2H5OH +3O2→2CO2 +3H2O,电池示意如右图,下列说法不正确的是
A.a极为电池的负极
B.电池工作时电流由a极沿导线经灯泡再到b极
C.电池工作时,1mol乙醇被氧化时就有12mol电子转移
D.电池正极的电极反应为:4H+ +O2+4e-=2H2O
2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200oC左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全。电池总反应为:
C2H5OH +3O2→2CO2 +3H2O,电池示意如右图,下列说法不正确的是
A.a极为电池的负极
B.电池工作时电流由a极沿导线经灯泡再到b极
C.电池工作时,1mol乙醇被氧化时就有12mol电子转移
D.电池正极的电极反应为:4H+ +O2+4e-=2H2O
第Ⅱ卷 (非选择题 共40分)
14. 将X、Y、Z、W四块金属分别用导线两两相连浸入稀硫酸中组成原电池。X、Y相连时,X为负极;Z、W相连时,电流由W→Z;X、Z相连时,Z极上产生大量气泡;W、Y相连时,W极发生氧化反应。据此判断四种金属活动性顺序是 A.X>Z>W>Y B.Z>X>Y>W C.X>Y>Z>W D.Y>W>Z>X
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com