
题目列表(包括答案和解析)
4、.用pH试纸测定某一溶液的pH时,规范的操作是 ( )
A.将pH试纸放入溶液中观察其颜色变化,跟标准比色卡比较
B.将溶液倒在pH试纸上,跟标准比色卡比较
C.用干燥洁净的玻璃棒蘸取溶液,滴在pH试纸上,跟标准比色卡比较
D.在试管内放少量溶液,煮沸,把pH试纸放在管口,观察颜色,跟标准比色卡比较
2、家庭中使用漂白粉时,为了增强漂白能力,可加入少量的物质是 ( )
A.食盐 B.食醋 C.烧碱 D.纯碱
3、原子结构模型的演变图中,⑴为道尔顿实心球式原子模型、⑵为卢瑟福行星运转式原子模型、⑶为汤姆生葡萄干面包式原子模型、⑷为近代量子力学原子模型、⑸为玻尔轨道式原子模型。其中符合历史演变顺序的一组排列是 ( )

|
A.⑴⑶⑵⑸⑷ B.⑴⑵⑶⑷⑸
C.⑴⑸⑶⑵⑷ D.⑴⑶⑸⑷⑵
1、碘缺乏病是目前已知的导致人类智力障碍的主要原因。为解决这一全国性问题,我国很久前已经开始实施“智力工程”,最经济可行的措施是 ( )
A.食盐加碘(盐) B.面包加碘(盐)
C.大量食用海带 D.注射含碘药剂
25.在含镁离子、铝离子的无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如右图所示。 由此确定:
(1)原无色溶液除Mg2+、Al3+外还含有的阳离子是 。
(2)原溶液中Mg2+、Al3+的物质的量之比为 。
(3)已知所加的氢氧化钠溶液的质量分数为14%(密度为1.15g/cm3),若要配制500毫升该氢氧化钠溶液,需要多少克氢氧化钠?配得溶液的物质的量浓度是多少?
24.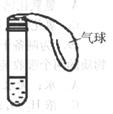 (12分)如右图所示,试管中盛有无色液体A,气球中装有固体B,将气球中的固体倒入液体A中,观察到有无色气泡产生,且气球涨大。
(12分)如右图所示,试管中盛有无色液体A,气球中装有固体B,将气球中的固体倒入液体A中,观察到有无色气泡产生,且气球涨大。
(1)若A中液体能使pH试纸显红色,则B可能是 ;
反应的化学方程式是 。
(2)若A中液体能使pH试纸显蓝色,则B可能是 ;
反应的化学方程式是 。
(3)若A中液体使pH试纸颜色无明显变化,则B可能是 ;
反应的化学方程式是 。
23.(13分)我们生活中的许多现象及大量物质的应用都与氧化还原反应有关。请运用氧化还原反应的知识回答下列问题:
(1)氯气与水反应生成的次氯酸(HClO)具有杀菌作用,常用于自来水的消毒。在次氯酸中,氯元素的化合价为 ,氯原子容易得到电子,从而使氯元素的化合价降低,因此次氯酸具有强 。
(2)实际生活中,常将漂白粉用于消毒,请写出工业上制取漂白粉的反应方程式:
(3)漂白粉在空气中长期露置会失效,原因是:(用方程式表示)
(4)自然界中存在的元素大多以化合态存在,而我们在生产和生活中需要许多单质,如金属铁、单质硅、氧气等。如果要把某元素由化合态变成单质,则它 (填序号)。
A. 被氧化 B. 被还原
C. 有可能被氧化,也有可能被还原 D. 由高价态变为零价
22.(10分)臭氧层因为能吸收太阳光中的紫外线而成为人类和生物的保护伞,但因为其很强的氧化性,如果在人类生活空间的大气中臭氧的体积分数大于10-5%时,对人体和动植物造成危害。某中学化学课外活动小组,想验证臭氧的氧化性强于氧气,通过资料收集和互联网查询最后筛选并设计实验原理和步骤:
(1)实验的反应原理:2KI+O3+H2O=2KOH+I2+O2 淀粉溶液遇单质碘变蓝色
(2)实验用品:臭氧消毒碗柜、 a 溶液、碘化钾溶液、滤纸、玻璃片、温度计。
(3)实验步骤:
①取a溶液与碘化钾溶液混和;
②取两片用滤纸剪成的纸条,在a溶液和碘化钾溶液的混和液中湿润后分别置于两块洁净的玻璃片上(命名为玻璃甲和乙);
③将玻璃片甲置于臭氧消毒碗柜中并接通电源生成臭氧。另玻璃片乙置于可控温度的温箱里,尽量地使温箱的温度与消毒碗柜中的温度相等。
④观察现象并进行记录:
|
时间(分钟) |
0 |
15 |
30 |
45 |
60 |
90 |
120 |
|
|
观察到滤纸的颜色变化 |
玻璃甲上的滤纸 |
白色 |
白色 |
灰色 |
浅蓝色 |
蓝色 |
蓝色 |
浅蓝色 |
|
玻璃乙上的滤纸 |
白色 |
白色 |
白色 |
白色 |
灰色 |
灰色 |
浅蓝色 |
请根据如上实验的原理、步骤及你所学的知识回答下列问题:
(1)实验药品中的a溶液是 溶液。
(2)整个实验过程要保持两块玻璃片所在环境的温度相同的原因是什么?
。
(3)写出在臭氧消毒柜中O2转化成O3的化学方程式 。
(4)从实验数据记录可以得出的结论是 (填序号)。
A、O3的氧化性比氧气强;
B、氧气也能氧化碘化钾中的碘离子;
C、空气中可能也有一定浓度的O3,所以实验数据不可靠,不能达到实验目的;
D、O3不仅氧化I-的速率比氧气快,而且有漂白作用。
21.(23分)
(1)铁是人体必需的微量元素,目前市售补铁制品较多,为保护消费者的利益,质检部门需对补铁剂中铁的含量进一步测定。
①将补铁剂中的Fe2+氧化成Fe3+,结合你所选的氧化剂写出相关的反应式:
_________________________________________________________________________
②将Fe3+用氨水沉淀为不溶于水的氢氧化铁,试写出发生反应的离子方程式:
_________________________________________________________________________
③举出一种检验Fe3+的化学试剂(所选试剂不能是碱类物质)和相关的实验现象
(2)生铁是一种铁合金,下面的实验可以粗略测定生铁样品的含碳量。把生铁高温灼烧,生铁中的碳和硫转化成CO2和SO2(SO2可以被KMnO4溶液吸收)气体,将气体通入下列装置:
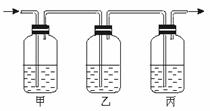
装置中盛放的溶液可从下列4种试剂中选择(每种试剂只能用一次)
①澄清石灰水 ②KMnO4 ③品红 ④浓H2SO4
那么,根据实验的需要,甲、乙、丙三个瓶盛的试剂依次最好是(填编号) 。
(3)若将水蒸气通入高温的还原铁粉,发生反应的化学方程式是:
(4)SO2是一种大气污染物,向大气中过量排放SO2将会形成酸雨污染。正常雨水pH约为_________。(选“5.6”“7.0”或“8.4”)。 为了防止污染,工厂收集排出的SO2并与空气反应合成三氧化硫(写出反应的化学方程式) 。三氧化硫通入浓氨水,可得到一种肥料(写出反应的化学的方程式)
。
20.纯碱和小苏打都是白色晶体,在日常生活中都可以找到。要在家庭将它们区分开来,下面的方法中可行的是
A.分别放在炒锅中加热,观察是否有残留物
B.分别用干净铁丝蘸取样品在煤气炉的火焰上灼烧,观察火焰颜色
C.在水杯中各盛相同质量的样品,分别加入等体积的白醋,观察反应的剧烈程度
D.将样品溶解,分别加入澄清石灰水,观察是否有白色沉淀
第II卷(非选择题 共70分)
19.下列各组中的两种物质作用时,反应条件(温度、反应物用量)改变,不会引起产物种类改变的是
A.Na和O2 B.Na2O2和CO2 C.NaOH和Al(OH)3 D.C 和O2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com