
题目列表(包括答案和解析)
2.下列关于氧化物的叙述中,正确的是
A.酸性氧化物在常温下均为气态 B.酸性氧化物均可与碱反应
C.金属氧化物都是碱性氧化物 D.不能与酸反应的氧化物一定能跟碱反应
1.下列物质属于纯净物的是
A.冰水混合物 B.无污染的空气 C.盐酸 D.漂白粉
6.如何避免因为生成H2O2造成的误差? 。
第Ⅹ题(10分)
某科研小组欲测定一种溶液中某微量的IO3-的浓度,采用“化学放大”的方法。取1L 含IO3-的该溶液和足量的KI溶液混合,加入一定量的H2SO4,使IO3-均转化为I2。用CCl4萃取I2(萃取率为100%),然后再用肼的水溶液将I2反萃取至水相(N2H4 + 2I2 = 4I-+ N2 + 4H+),再用过量的Br2氧化,除去剩余的Br2后加入过量的KI,加H2SO4酸化,此时被Br2氧化后所得的IO3-又与I-结合生成I2。用淀粉做指示剂,用Na2S2O3标准溶液(c = 0.100 mol·L-1)滴定,消耗Na2S2O3 20.06 mL。试计算原溶液中IO3-的浓度。
5.通过以上数据计算,该过氧化钠的纯度为 。
4.为校正实验结果,该学生补做了如下实验:用移液管移取20.00 mL容量瓶中的液体,放入锥形瓶中,用0.0100 mol/L的KMnO4溶液去测定,至溶液中刚好出现浅浅的紫红色,停止滴定,用去了24.00 mLKMnO4溶液。反应式:2KMnO4 + 5H2O2 + 3H2SO4 = K2SO4 + 2MnSO4 + 5O2↑ + 8H2O,该实验应选用 式滴定管。
3.据研究,与上述反应同时发生的反应还有 : Na2O2 + 2H2O = 2NaOH + H2O2,H2O2的生成会使测定结果 (偏高或偏小)。
2.生成气体体积是 mL, 为保证生成气体体积的准确性读取量筒刻度时应注意的问题是 。
1.有1 000 mL、 500 mL 、250 mL的量筒备用,则应选用 mL的量筒,理由是 。
3.计算出1160℃时,反应所得产物的摩尔质量: 。
第Ⅸ题(16分)
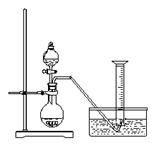
某同学设计了如下方案,来测定过氧化钠的样品的纯度(杂质不参加反应,条件为标准状况)。
实验原理:2Na2O2 + 2H2O = 4NaOH + O2↑
通过测定生成的氧气的体积,经计算可确定样品过氧化钠的质量。
实验步骤:
① 称取过氧化钠固体2.00 g ;
② 把这些过氧化钠放入气密性良好的气体发生装置中;
③ 向过氧化钠中滴入水,用量筒排水集气,量筒内液
面在110 mL处恰与水槽内液面相平;
④ 作为反应器的烧瓶中有54.0 mL液体;
⑤ 将烧瓶内的液体转移到250 mL的容量瓶内,并加水定容。
请回答下列问题:
2.写出325℃ ~ 700℃时发生的化学反应方程式: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com