
题目列表(包括答案和解析)
3、分类法是一种行之有效、简单易行的科学方法,人们在认识事物时可以采取多种分类方法。下列关于“Na2SiO3”的分类不正确的是
A.电解质 B.硅酸盐 C.钠盐 D.碱性氧化物
2、实验室下列物质的保存方法中,不正确的是
A.铝片放在不密封的容器里 B.氢氧化钠溶液盛装在用玻璃塞的试剂瓶中
C.硫酸亚铁溶液存放在加有少量铁粉的试剂瓶中 D.金属钠保存在石蜡油或煤油中
1、硅被誉为无机非金属材料的主角。下列产品的主要成分不是硅酸盐的是
A.光导纤维 B.玻璃 C.水泥 D.陶瓷餐具
22.(6分)过氧化钠能与水发生反应:2Na2O2+2H2O 4NaOH+O2↑。某同学用该反应制取标准状况下1.12 L氧气。
4NaOH+O2↑。某同学用该反应制取标准状况下1.12 L氧气。
⑴计算至少需要称取过氧化钠的质量。
⑵若反应所得氢氧化钠溶液的体积是200 mL,计算该溶液中溶质的物质的量浓度。
21.(8分)某同学按下列步骤配制500 mL 0.200 mol·L-1KCl溶液,请回答有关问题。
|
实验步骤 |
有关问题 |
|
⑴计算所需KCl的质量 |
需要KCl的质量为____________g |
|
⑵称量KCl固体 |
称量过程中主要用到的仪器是___________ |
|
⑶将KCl加入100 mL烧杯中 |
为加快溶解速率,可采取的措施是__________ |
|
⑷将烧杯中的溶液转移至500
mL容量瓶中 |
为防止溶液溅出,应采取的措施是__________
_________ |
|
⑸向容量瓶中加蒸馏水至刻度线 |
在进行此操作时应注意的问题是____________
________________________________________ |
你认为按上述步骤配制的KCl溶液的浓度是否为0.200 mol·L-1,请说明理由。
20.(14分)下面是元素周期表的简略框架图。
|
a |
|
|
|||||||||||||||
|
|
|
|
|
b |
c |
d |
|
|
|||||||||
|
e |
f |
|
|
g |
|
h |
i |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
回答下列问题:
⑴元素a在元素周期表中的位置是___________________,元素i的原子核外最外层电子数为________,元素f和h形成化合物的电子式是_____________________。
⑵元素c和g中,非金属性较强的是__________(填元素符号),支撑这一结论的化学事实是___________________________________________。
⑶写出由cd2转化为cd的化学方程式:______________________________________;b、d、e形成的一种盐俗称纯碱,其中常混有其对应的酸式盐,用化学方程式表示除去该酸式盐的方法:___________________________________________。
19.(8分)下图中,A、B、C、D、E含有同一元素,A为红棕色固体,B为黑色粉末,C的溶液呈黄色,D的溶液呈浅绿色,E为白色沉淀且在空气中迅速转变为灰绿色最终变为红褐色。X是一种酸性稀溶液,Y是一种碱性稀溶液,其他生成物均已略去。
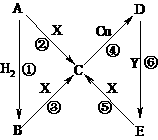
填写下列空白:
⑴A的化学式是__________,X的化学式是__________。
⑵反应④的离子方程式是__________________________________,该反应中的氧化剂是_____________。
18.(10分)某同学实验室用下列装置探究氯气的性质。
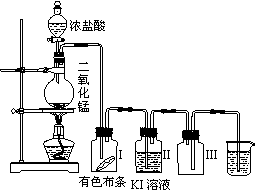
⑴实验室用二氧化锰和浓盐酸反应制取氯气,同时生成二氯化锰和水,写出该反应的化学方程式并用单线桥标出电子转移的方向和数目。
⑵实验时发现有色布条褪色,其原因是______________________________________;实验结束后,要从广口瓶Ⅱ中分离出固态I2,应采用的方法是先______________,再蒸馏。
⑶烧杯中溶液的作用是_______________,广口瓶Ⅲ的作用是___________________。
17.(6分)某研究小组拟用定量的方法测量Al和Fe分别与酸反应的快慢,设计了下图1所示的装置。

⑴检查图1装置气密性的方法是______________________________________。
⑵若要比较产生气体的快慢,可以测量相同时间内产生气体的体积,也可以测量___________________________________。
⑶实验测得铝丝产生气体的速率(v)与时间(t)的关系如上图2所示,则t1-t2时间内反应速率逐渐加快的主要原因是_______________________________________。
16.向100 mL 1.0 mol·L-1的AlCl3溶液中逐滴加入0.5 mol·L-1的NaOH溶液至过量,生成沉淀的物质的量与加入NaOH的量的理论曲线图正确的是
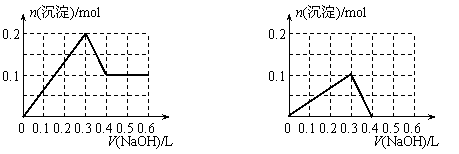
A B

C D
第Ⅱ卷(非选择题 共52分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com