
题目列表(包括答案和解析)
1﹒孔林、孔庙、孔府是著名的旅游景点,近几年,修建的高速公路绕开了孔林、孔庙、孔府,以减少污染。你认为,在三孔景区,这样能有效减少的主要是
A﹒车辆排放的大气尾气 B﹒居民燃煤所产生SO2气体
C﹒车辆尘埃、生活垃圾 D﹒工厂所排“三废”
2﹒下列每组分别给出了两个量,其中可以组成一个物质的量的公式的组有
|
① |
② |
③ |
④ |
⑤ |
|
物质微粒数 |
固体体积 |
溶液的质量百分比浓度 |
标准状况下气体的摩尔体积 |
非标准状况下某物质的质量 |
|
阿伏加德罗常数 |
固体密度 |
溶液体积 |
标准状况下气体的体积 |
物质的摩尔质量 |
A﹒①②⑤ B﹒②③④ C﹒①④⑤ D﹒①③④
3﹒物质分类的依据通常是根据它的组成和性质,下列物质的分类中,只考虑组成的是
A﹒硫酸钠是钠盐、硫酸盐、正盐
B﹒二氧化硫是氧化物、酸酐、有漂白性物质
C﹒氢氧化钠是一元碱、易溶性碱、强碱
D﹒碳酸氢钠是钠盐、酸式盐、易分解的盐
4﹒“纳米材料”是粒子直径为1nm-100nm的材料,纳米碳就是其中的一种。某研究所将纳米碳均匀的分散到蒸馏水中,得到的物质①是溶液 ②是胶体 ③具有丁达尔现象 ④不能透过半透膜 ⑤不能透过滤纸 ⑥静止后会出现黑色沉淀。其中正确的是
A﹒①④⑥ B﹒②③⑤ C﹒②③④ D﹒①③④⑥
5﹒下列离子方程式改写成化学方程式正确的是
A﹒Cu2+ + 2OH- = Cu(OH)2↓
CuCO3 + 2NaOH = Cu(OH)2↓ + Na2CO3
B﹒CO32- + 2H+ = CO2↑ + H2O
BaCO3 + 2HCl = BaCl2 +CO2↑ + H2O
C﹒Fe+ 2H+ = H2↑ +Fe2+
Fe+ 2HNO3 = H2↑ +Fe(NO3)2
D﹒H+ + OH- = H2O
2KOH + H2SO4 = K2SO4 + 2H2O
6﹒对四种无色溶液进行离子检验,实验结果如下,其中明显错误的是
A﹒K+ 、Na+、Cl-、NO3- B﹒Cu2+、NO3-、OH-、HCO3-
C﹒Na+、OH-、Cl-、NO3- D﹒K+ 、 Na+、 S2-、 Cl-
7﹒下列反应中,CO2作氧化剂的是
A﹒Ca(OH)2+ CO2 = CaCO3↓ + H2O
B﹒CO2 + C  2CO
2CO
C﹒2Fe2O3 +
3C  4Fe +3CO2↑
4Fe +3CO2↑
D﹒C+ 2H2O  2H2+ CO2
2H2+ CO2
8﹒地壳中含量第一和第二的两种元素所形成的化合物不具有的性质是
A﹒熔点很高 B﹒与水反应生成对应的酸
C﹒可与烧碱反应生成盐 D﹒坚硬
9﹒铜粉加入稀盐酸中,加热无现象,这时加入一种盐则铜粉溶解而溶液变蓝,同时有气体放出,这种盐是
A﹒NaCl B﹒KNO3 C﹒FeCl2 D﹒Fe2(SO4)3
10﹒固体甲与盐酸反应得到溶液乙,乙与氢氧化钠溶液反应生成沉淀丙,一段时间后,将丙加热又得到甲,则甲可能是
A﹒Fe B﹒Al C﹒FeO D﹒CuO
11﹒某溶液中,滴加KSCN溶液时无明显现象发生,再滴入少量氯水,溶液立即显红色。则原溶液中一定含有的是
A﹒Fe2+ B﹒Fe3+ C﹒K+ D﹒NH4+
12﹒用坩埚钳夹住一小块刚用盐酸处理过的铝箔,在酒精灯上加热至熔化,发现熔化的铝箔不滴落。下列关于上述实验中有关问题的解释不正确的是
A﹒铝箔熔化,失去金属光泽 B﹒铝在空气中能很快形成氧化膜
C﹒氧化铝的熔点比铝高 D﹒氧化铝与盐酸不反应
13﹒将预先称量的20g蔗糖放入100mL烧杯中,加几滴水搅拌均匀,再加入15mL浓硫酸,用玻璃棒迅速搅拌,观察到蔗糖由白变黑,体积膨胀,呈疏松海绵状,有刺激性气味气体生成,放出大量的热,在此过程中浓硫酸没表现出的化学性质是
A﹒吸水性 B﹒脱水性 C﹒酸性 D﹒氧化性
14﹒关于硝酸的说法正确的是
A﹒硝酸与金属反应时,主要是+5价的氮得电子
B﹒浓硝酸与浓盐酸按3︰1的体积比所配成的溶液叫王水
C﹒硝酸电离出的氢离子,内被Zn、Fe等金属还原成H2
D﹒常温下,向浓硝酸中投入Fe片,会产生大量的红棕色气体
15﹒下列选项的括号内是除去杂质所用的试剂,其中错误的是
A﹒二氧化氮中混有NO(水)
B﹒NaNO3溶液中混有Na2SO4(Ba(NO3)2)
C﹒氯气中混有水蒸气(浓硫酸)
D﹒氨气中混有水蒸气(NaOH固体)
16﹒下列两种物质中所含分子数目相同的是
A﹒2g氢气和8g氦气
B﹒常温常压下,2L氢气和2L水
C﹒常温常压下1mol氧气和标准状况下32g氧气
D﹒常温常压下,22.4L氧气和2g氢气
17﹒现有两种气体,SO2和Cl2,下列方法或试剂(必要时可加热)能用于鉴别它们的是:①观察颜色 ②石蕊试剂 ③品红溶液
A﹒只有①② B﹒只有①③ C﹒只有②③ D﹒①②③
第II卷(非选择题 共49分)
26.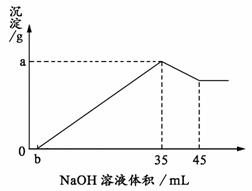 (7分)取6 g铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有100 mL H2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10
mol/L的NaOH溶液, 产生沉淀的量与所加NaOH溶液的体积的关系如右图所示。 试求:
(7分)取6 g铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有100 mL H2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10
mol/L的NaOH溶液, 产生沉淀的量与所加NaOH溶液的体积的关系如右图所示。 试求:
(1) 硫酸溶液的物质的量浓度。
(2) 若b = 2.3,则铝土矿中氧化铁的质量分数是多少?
24.(4分)电解饱和食盐水可产生氯气、氢气和氢氧化钠,氯气和石灰乳反应可制得漂白粉。
(1)若电解饱和食盐水的过程中有10 mol 电子发生转移,试计算理论上最多可制得氯气的体积(标准状况)是多少?。
(2)若将制得的氯气通入足量的石灰乳中,理论上可得到次氯酸钙多少克?
23.(8分) 据统计,2006年一季度江苏省粗钢产量为748.23万吨,同比增加254.86万吨;钢铁工业已成为我省重要的支柱产业。某大型铁矿附近有炼焦煤、石灰石、黏土矿和丰富的水资源。
(1) 随着铁矿的开发,该地建立了如下图所示位置关系的炼焦厂、钢铁厂、发电厂和水泥厂。
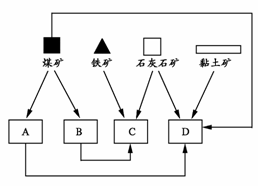
请写出图中B、D所代表的两个工厂的名称:B.____________;D.___________。
(2) 硫铁矿其外观如黄金,故其又被称为“愚人金”。现有黄金、愚人金两种小块试样,提供的仪器主要有:
A.托盘天平 B.酒精喷灯 C.试管夹 D.坩埚钳 E.烧杯 F.量简
另外,H2O、空气可任意选用,请回答问题:
① 若用物理方法来鉴别该黄金、愚人金试样,应选用的仪器为 (填代号);
② 若用化学方法来鉴别该黄金、愚人金试样,应选用的仪器为 (填代号)。
(3) 某发电厂每天排放1.12×103m3(标准状况)尾气,其中含0.02%(体积分数)的SO2,现欲用2.0.mol/L 氢氧化钠溶液进行处理,每天至少需要氢氧化钠溶液的体积是 L。
22.(10分) A-I分别表示中学化学中的常见物质,它们之间的相互转化关系如下图所示(部分反应物、生成物没有列出),且已知G是一种两性氧化物,A、B、C、D、E、F六种物质中均含有同一种元素,F为红褐色沉淀。
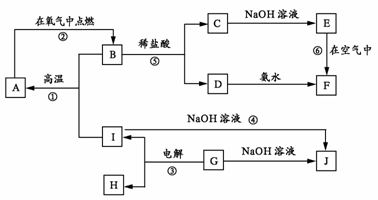
请填写下列空白:
(1) A、B、C、D、E、F六种物质中所含的同一种元素是 (写元素符号)。
(2) 写出物质C、G的化学式:C ,G 。
(3) 写出反应①、⑥的化学方程式:
反应①: 。
反应⑥: 。
21.(9分)写出下列反应的化学方程式或离子方程式。
(1)漂白粉溶液中通入过量的二氧化碳的化学方程式 ________ _______ ____________。
(2)足量的氯气通入到溴化亚铁溶液中的离子方程式____________________ _______。
(3)铝与氢氧化钠溶液反应的离子方程式_____________________________ _______。
(4)二氧化硫使溴水褪色的化学方程式并标出该反应中电子转移的方向和数目
_____________________________________________________________________________。
20.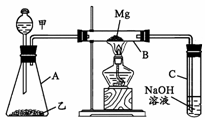 (10分) 某研究性学习小组认为SiO2、SO2和CO2都是
(10分) 某研究性学习小组认为SiO2、SO2和CO2都是
酸性氧化物,化学性质应具有一定的相似性,他们以
课本知识“Mg在点燃的条件下可与CO2反应”为基
础,设计了如右图所示装置进行Mg和SO2反应的实
验。据此请回答:
(1)若用下列物质中的两种相互混合反应制取SO2,则这两种物质最好是_______(填代号)。
① 10%的H2SO4溶液 ② 50%的H2SO4溶液 ③ Na2SO3固体 ④ CaSO3固体
(2)写出装置B中发生的主要反应的化学方程式________________________________。
装置C中NaOH溶液的作用是________________________________________。
(3)你认为该装置是否有不足之处?如果有,请说明之。答:______________ __________
_________________________________________。
(4)有同学认为,B管中的生成物中含有MgS,请你设计实验方案加以证明。答:_____________
__________________________________________________________________。
19.(5分)下列有关实验操作或判断不正确的是 _____________(填序号,多选扣分)。
A.配制一定物质的量浓度溶液,定容时俯视刻度线会导致所配溶液浓度偏大。
B.用干燥的pH试纸测定氯水的pH。
C.配制稀硫酸时,可先在烧杯中加入一定体积的蒸馏水,再边缓慢加入浓硫酸边搅拌。
D.100 mL容量瓶可用于配制95 mL 0.1 mol/L NaCl溶液。
E.在天平左右两盘中各放一张白纸后,即可将NaOH固体放在白纸上称量。
F.观察钾元素焰色反应的操作是:先将铂丝放在稀盐酸中洗涤,然后蘸取固体氯化钾,置于酒精灯的火焰上进行灼烧,透过蓝色钴玻璃进行观察。
G.苯、CCl4、酒精可用来萃取溴水中的溴。
2.答卷前将密封线内的项目填写清楚。
18. 在保持平衡的天平的左右两盘中各放一只大小和质量均相同的烧杯,两烧杯中都盛有1?mol/L的稀硫酸100?mL,然后分别向两烧杯中加入一定质量的金属,充分反应后天平仍保持平衡,则金属的质量分别是( )
A.4.6 g Na,4.8 g Mg B.5 g Na,5 g Al
C.2.3 g Na,2 .4 g Mg D.1.8 g Al,2.4 g Mg
高一化学试题
第二卷 (非选择题 共54分)
l.用钢笔或圆珠笔(除题目有特殊规定外)直接答在试卷上。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com