
题目列表(包括答案和解析)
26、
25、
32、(6分)将含过量氧气和乙烯及某烷烃组成的混合气体20L,点燃爆炸反应后,气体体积仍为20L(120℃,1.01×105Pa),然后将气体通过足量的碱石灰,剩余气体2L,若仅通过浓硫酸,则体积变为10L。求烷烃的分子式及原来乙烯的体积。
|
|
|
|
|
题 |
|
名 姓 |
答 |
|
|
准 |
|
号 学 |
不 |
|
|
内 线 |
|
级 班 |
封 |
|
|
密 |
|
校 学 |
|
|
|
|
高一化学限时试卷答卷纸
31、(6分)在1.01×105Pa 120℃条件下,将1L丙烷和若干升O2混合点燃,燃烧后,恢复到原来的状态,测得混合气体的体积为m L,将燃烧后的气体再通过碱石灰,气体剩余n L,已知m-n=a,请分析后填写下列空白:
(1)若a=6,则n L气体成分只能是 。
(2)若燃烧前后始终保持1.01×105Pa和120℃,则a的最大值为 ,你确定该最大值的理由是 。
30、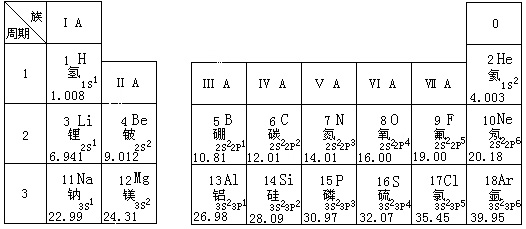 (6分)根据你对下列元素周期表的理解,回答有关问题:
(6分)根据你对下列元素周期表的理解,回答有关问题:
(1)用电子式表示上列元素中最活泼的金属元素与最活泼的非金属元素所形成化合物的过程_________________________________________________________。
(2)镁、铝最高价氧化物对应的水化物中,碱性比较强的是_____________(用化学式表示)。
(3)在ⅦA元素(Br、I分别位于第四、五周期)中,能够证明Cl2 的氧化性比I2 的氧化性强的实验是__________________________________________(用离子反应方程式表示)。
29、(4分)现代原子结构理论认为,在同一电子层上,可有s、p、d、f、g、h……等能级,各能级分别有1、3、5、……个轨道。试根据电子填入轨道的顺序预测:
(1)第八周期共有 种元素;
(2)根据“稳定岛”假说,第114号元素是一种稳定同位素,半衰期很长,可能在自然界都可以找到。试推测第114号元素属于 周期, 族元素,原子的价电子构型是 。
28、(5分)1932年美国化学家鲍林首先提出电负性的概念。电负性(用X表示)也是元一种衡量元素金属性和非金属的重要性质,下表给出的是原子序数小于20的16种元素的电负性数值:请仔细分析下表数据,回答下列有关问题:
|
元素 |
H |
Li |
Be |
B |
C |
N |
O |
F |
|
电负性 |
2.1 |
1.0 |
1.5 |
2.0 |
2.5 |
3.0 |
3.5 |
4.0 |
|
元素 |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
K |
|
电负性 |
0.9 |
1.2 |
1.5 |
1.7 |
2.1 |
2.3 |
3.0 |
0.8 |
① 预测周期表中电负性最大的元素应为____________;估计钙元素的电负性的取值范围:___________< X <___________。
②经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中形成的化学键的类型为______________,其理由是_______________________。
27、(19分)(1)①下表为烯烃类化合物与溴发生加成反应的相对速率(以乙烯为标准)。
|
烯烃类化合物 |
相对速率 |
|
(CH3)2C=CHCH3 |
10.4 |
|
CH3CH=CH2 |
2.03 |
|
CH2=CH2 |
1.00 |
|
CH2=CHBr |
0.04 |
据表中数据,总结烯烃类化合物加溴时,反应速率与C=C上取代基的种类、个数间的关系:(4分)
____________________________________ _ _____ 。
②(2分)下列化合物与氯化氢加成时,取代基对速率的影响与上述规律类似,其中反应速率最慢的是______________(填代号)。
A.(CH3)2C=C(CH3) 2 B.CH3CH=CHCH3
C.CH2=CH2 D.CH2=CHCl
(2)已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2 2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。

回答下列问题:
①(2分)写出A的电子式 。
②(2分)B、D分子中的官能团名称分别是 、 。
③(3分)写出下列反应的反应类型:① ,② ,④ 。
④写出下列反应的化学方程式:(6分)
① ;
② ;
④ 。
26、(10分)周期表里的四种主族元素相对位置如右图所示。已知它们的原子序数总和为46,则
|
m |
n |
|
|
|
|
|
x |
y |
(1)元素n的原子序数为 ;
(2)用电子排布式表示x原子的价电子结构 ;
(3)m与y所形成的化合物的化学式是 。
(4)X与y相比,电负性较大的是 ,理由是 。
25、(4分)按构造原理写出35号元素的基态原子的电子排布式:__________ __;其价电子层轨道表示式为___ __;最高正化合价为: _ _;其简单离子的离子结构示意图 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com